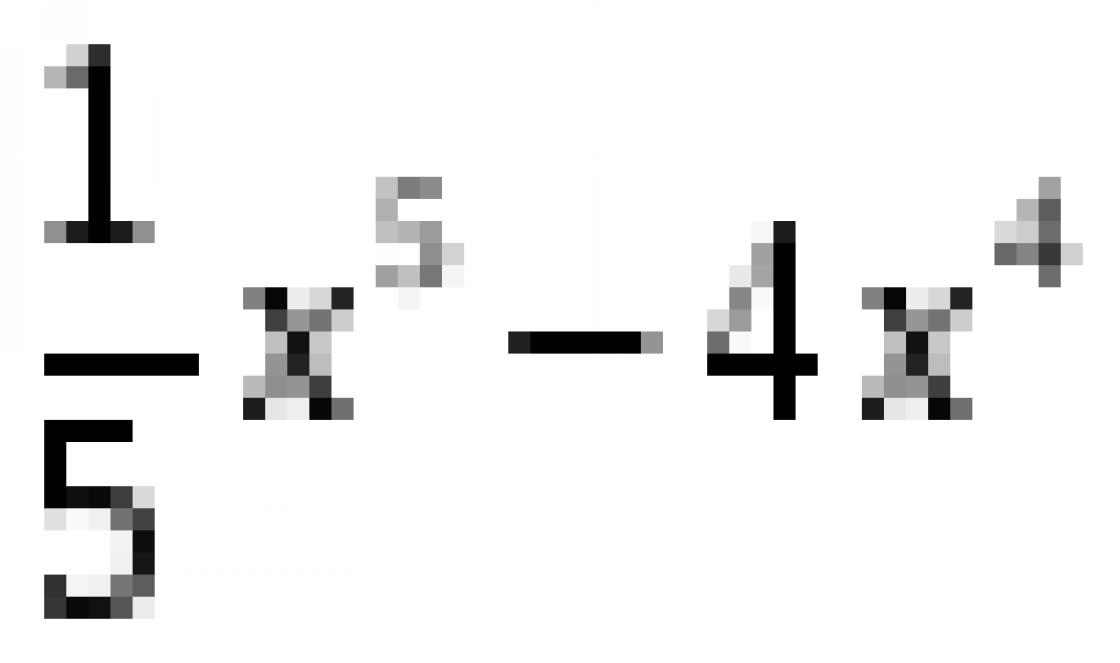Все металлы в твердом состоянии имеют кристаллическое строение. Атомы в твердом металле расположены упорядочение и образуют кристаллические решетки (рис. 1).
Рис. 1. Схемы кристаллических решеток: а – объемно-центрированная кубическая; б –гранецентрированная; в – гексагональная плотноупакованная
Кристаллическая решетка представляет собой наименьший объем кристалла, дающий полное представление об атомной структуре металла, и носит название элементарной ячейки.
Для металлов характерны кристаллические решетки трех видов: кубическая объемно-центрированная (ОЦК), в которой атомы расположены по вершинам элементарной ячейки и один в ее центре; кубическая гранецентрированная (ГЦК), в которой атомы расположены по вершинам элементарной ячейки и в центрах ее граней; гексагональная плотноупакованная (ГПУ), представляющая собой шестигранную призму, в которой атомы расположены в три слоя.
Свойства материала зависят от вида кристаллическ4ой решетки и параметров, ее характеризующих:
1) межатомное расстояние , измеряется в ангстремах 1А°=10 -8 см
2) плотность упаковки (базис решетки – число частиц, приходящихся на одну элементарную ячейку). Кубическая простая – Б1, ОЦК – Б2, ГЦК – Б4, ГПУ – Б6.
3) координационное число (КЧ) – максимальное количество атомов равноудаленных и находящихся на ближайшем расстоянии от атома, взятоого за точку отсчета. Кубическая простая – КЧ=6, ОЦК – КЧ=8, ГЦК – КЧ=12, ГПУ – КЧ=12.

Свойства материала, определенные в направлении передней плоскости и диагональной плоскости, отличаются – это явление называется анизотропия , т. е. неравномерность свойств в различных направлениях. Этим свойством обладают все металлические материалы. Аморфные тела обладают свойством изотропии , т.е. имеют одинаковые свойства во всех направлениях.
Кристаллические решетки могут иметь различные структурные несовершенства, существенно изменяющие свойства материала. Реальный единичный кристалл всегда имеет свободную (наружную) поверхность, на которой уже вследствие поверхностного натяжения решетка искажена.
Дефекты внутреннего строения подразделяют на точечные, линейные и плоскостные.
К точечным дефектам относятся вакансии (когда отдельные узлы кристаллической решетки не заняты атомами); дислоцированные атомы (если отдельные атомы оказываются в междоузлиях) или примесные атомы, количество которых даже в чистых металлах весьма велико. Около таких дефектов решетка будет упруго искаженной на расстоянии одного-двух периодов (рис. 2, а).

Рис. 2. Дефекты кристаллической решетки : а - точечные; б - линейные; в - плоскостные
Линейные дефекты малы в двух измерениях и достаточно велики в третьем. К таким дефектам относятся смещение атомных плоскостей или дислокации и цепочки вакансий (рис. 2,б). Важнейшим свойством таких дефектов являются их подвижность внутри кристалла и активное взаимодействие между собой и с другими дефектами.
Изменение кристаллической решетки материала возможно под воздействием внешних факторов, а именно температуры и давления. Некоторые металлы в твердом состоянии в различных температурных интервалах приобретают разные кристаллические решетки, что всегда приводит к изменению их физико-химических свойств.
Существование одного и того же металла в нескольких кристаллических формах носит название полиморфизма . Температура, при которой происходит изменение кристаллической решетки – называется температурой полиморфного превращения. На этом явлении основаны все процессы термической обработки. Полиморфные модификации обозначают греческими буквами (a, b, g и другими, которые в виде индекса добавляют к символу элемента).

Гранецентрированная кубическая ячейка, относящаяся к кубической сингонии; Смотри также: Ячейка электролитическая ячейка гранецентрированная ячейка …
Ячейка - : Смотри также: электролитическая ячейка гранецентрированная ячейка базоцентрированная ячейка … Энциклопедический словарь по металлургии
ЯЧЕЙКА ГРАНЕЦЕНТРИРОВАННАЯ КУБИЧЕСКАЯ - один из 14 типов решеток Браве. Характеризуется расположением узлов по вершинам и в центрах всех граней куба. Геологический словарь: в 2 х томах. М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978 … Геологическая энциклопедия
кубическая сингония - кристаллографическая сингония, для которой характерно соотношение между углами и рёбрами элементарной ячейки кристалла: а = b = с, α = β = γ = 90º. Подразделяется на 5 классов (точечных групп симметрии). * * * КУБИЧЕСКАЯ СИНГОНИЯ КУБИЧЕСКАЯ… … Энциклопедический словарь
кубическая решетка (К6) - кристаллическая решетка, элементарная ячейка которой относится к кубической сингонии; Смотри также: Решетка триклинная решетка тетрагональная решетка пространственная решетка … Энциклопедический словарь по металлургии
Кубическая сингония
Кубическая гранецентрированная решётка - В кристаллографии кубическая сингония одна из семи сингоний. Элементарная ячейка кристалла кубической сингонии определяется тремя векторами равной длины, перпендикулярными друг другу. В кубической сингонии существует три вида решёток Бравэ:… … Википедия
Кубическая решетка - В кристаллографии кубическая сингония одна из семи сингоний. Элементарная ячейка кристалла кубической сингонии определяется тремя векторами равной длины, перпендикулярными друг другу. В кубической сингонии существует три вида решёток Бравэ:… … Википедия
Кубическая решётка - В кристаллографии кубическая сингония одна из семи сингоний. Элементарная ячейка кристалла кубической сингонии определяется тремя векторами равной длины, перпендикулярными друг другу. В кубической сингонии существует три вида решёток Бравэ:… … Википедия
электролитическая ячейка - сосуд с электролитом, снабженный электродами, в котором реализуются электрохимическии реакции; основной конструкционный элемент промышленных электролизеров. Конструкции электролитической ячейки чрезвычайно разнообразны. В… … Энциклопедический словарь по металлургии
гранецентрированная ячейка - элементарная ячейка кристалла в виде параллелепипеда, в центре каждой грани которого располается дополнительный атом, однотипный атомам в его вершинах; Смотри также: Ячейка электролитическая ячейка … Энциклопедический словарь по металлургии
Большинство твердых веществ имеют кристаллическую структуру , в которой частицы, из которых она «построена» находятся в определенном порядке, создавая тем самым кристаллическую решетку . Она строится из повторяющихся одинаковых структурных единиц - элементарных ячеек , которая связывается с соседними ячейками, образуя дополнительные узлы. В результате существует 14 различных кристаллических решеток.
Типы кристаллических решеток.
В зависимости от частиц, которые стоят в узлах решетки, различают:
- металлическую кристаллическую решетку;
- ионную кристаллическую решетку;
- молекулярную кристаллическую решетку;
- макромолекулярную (атомную) кристаллическую решетку.
Металлическая связь в кристаллических решетках.
Ионные кристаллы обладают повышенной хрупкостью, т.к. сдвиг в решетке кристалла (даже незначительный) приводит к тому, что одноименно заряженные ионы начинают отталкиваться друг от друга, и связи рвутся, образуются трещины и расколы.
Молекулярная связь кристаллических решеток.
Основная особенность межмолекулярной связи заключается в ее «слабости» (ван-дер-ваальсовые, водородные).

Это структура льда. Каждая молекула воды связана водородными связями с 4-мя окружающими ее молекулами, в результате структура имеет тетраэдрический характер.
Водородная связь объясняет высокую температуру кипения, плавления и малую плотность;
Макромолекулярная связь кристаллических решеток.
В узлах кристаллической решетки находятся атомы. Эти кристаллы разделяются на 3 вида:
- каркасные;
- цепочечные;
- слоистые структуры.
Каркасной структурой обладает алмаз - одно их самых твердых веществ в природе. Атом углерода образует 4 одинаковые ковалентные связи, что говорит о форме правильного тетраэдра (sp 3 - гибридизация). Каждый атом имеет неподеленную пару электронов, которые также могут связываться с соседними атомами. В результате чего образуется трехмерная решетка, в узлах которой только атомы углерода.
Энергии для разрушения такой структуры требуется очень много, температура плавления таких соединений высока (у алмаза она составляет 3500°С).
Слоистые структуры говорят о наличии ковалентных связях внутри каждого слоя и слабых ван-дер-ваальсовых - между слоями.
Рассмотрим пример: графит. Каждый атом углерода находится в sp 2 - гибридизации. 4-ый неспаренный электрон образует ван-дер-ваальсовую связь между слоями. Поэтому 4ый слой очень подвижен:

Связи слабые, поэтому их легко разорвать, что можно наблюдать у карандаша - «пишущее свойство» - 4ый слой остается на бумаге.
Графит - отличный проводник электрического тока (электроны способны перемещаться вдоль плоскости слоя).
Цепочечными структурами обладают оксиды (например, SO 3 ), который кристаллизуется в виде блестящих иголок, полимеры, некоторые аморфные вещества, силикаты (асбест).
Кристалл с определенной химической формулой имеет присущую ему кристаллическую структуру.
Кристаллические структуры - это структуры, представляющие периодическую решетку, в узлах которой расположены атомы. Трехмерная кристаллическая структура представляет решетку, построенную на трех координатных осях x, y, z, расположенных в общем случае под углами a, b, g . Периоды трансляции атомов по осям (параметры решетки) равны, соответственно, a, b, c. Элементарная ячейка кристалла - это параллелепипед, построенный на векторах трансляции a, b, c. Такая ячейка называется примитивной.
В результате трансляции элементарной ячейки в пространстве получается пространственная простая решетка - так называемая решетка Браве. Существует четырнадцать типов решеток Браве. Эти решетки отличаются друг от друга видом элементарных ячеек.
Решетки Браве подразделяются на семь систем, называемых кристаллографическими сингониями, в соответствии с семью различными типами элементарных ячеек: триклинной, моноклинной, ромбической, тетрагональной, тригональной, кубической и гексагональной. Эти элементарные ячейки могут быть как примитивными, так и сложными.
На рисунке изображены сложные элементарные ячейки.
а)объемноцентрированная б)гранецентрированная
в) базоцентрированная г) гексагональная
Объемноцентрированная
(ОЦ) ячейка (рис. а) - содержит дополнительно один атом на пересечении пространственных диагоналей куба (или, в общем случае, параллелепипеда). В ОЦ кубической структуре (ОЦК) кристаллизуются такие металлы, как 23 V, 24 Cr, 26 Fe, 41 Nb, 73 Ta, 74 W (индекс слева внизу обозначает номер элемента в периодической системе элементов Д. И. Менделеева
).
Гранецентрированная
(ГЦ) ячейка (рис. б) - содержит дополнительно по одному атому в плоскости каждой грани. В ГЦ кубической структуре (ГЦК) кристаллизуются металлы 13 Al, 28 Ni, 29 Cu, 47 Ag, 78 Pt, 79 Au и др.
Базоцентрированная
(БЦ) ячейка (рис. в) - содержит дополнительно по одному атому в центрах противоположных граней.
Гексагональная ячейка
(рис. г) состоит из трех примитивных ячеек, и, как и БЦ ячейка, содержит по одному атому в центре противоположных граней. В гексагональной структуре кристаллизуются многие металлы - 22 Ti, 27 Co, 30 Zn, 39 Y, 40 Zr, 64 Gd, 71 Lu.
Различные кристаллографические систем отличаются друг от друга формой элементарной ячейки: соотношениями между длинами ребер a, b и c и углами α, β и γ между гранями.
В триклинной
системе (где нет осей и плоскостей симметрии) такая ячейка представляет собой параллелепипед, все ребра и углы которого не равны между собой. В моноклинной
- это наклонный параллелепипед; в ромбической
(или орторомбической) - прямоугольный параллелепипед с неравными ребрами, в тетрагональной
- прямоугольный параллелепипед, в основании которого лежит квадрат; в тригональной
(ромбоэдрической) - прямоугольный ромбоэдр, стороны которого равны, а углы одинаковы, но отличны от 90 о и меньше, чем 120 о; в гексагональной
- прямую призму, основанием которой является ромб с углами 120 о и 60 о, а три ячейки составляют шестигранную призму; в кубической системе элементарная ячейка представляет собой куб.
В настоящее время выделено уже более тысячи структурных типов, однако они охватывают лишь несколько процентов известных кристаллических структур.
В международной классификации по группам структур принята следующая классификация:
А
- элементы;
В
- соединения типа АВ (например, NaCl, CsI);
С
- соединения типа AB 2 (CaF 2 , TiO 2);
D
- соединения типа A n B m (Al 2 O 3);
E
- соединения, образованные больше, чем двумя сортами атомов без радикалов или комплексных ионов (например, CuFeS);
F
-структуры соединений с двух- или трехатомными ионами (KCNS, NaHF 2);
G
- соединения с четырехатомными ионами (CaCO 3 , NaClO 3);
H
- соединения с пятиатомными ионами (CaSО 4 .2H 2 O, CaWO 4);
L
- сплавы;
S
-силикаты.
Разновидности типов внутри группы различаются номерами.
Понятие структурный тип
- один из критериев сходства или различия строения кристаллов. Обычно структурный тип относят к названию одного из веществ, кристаллизующихся в нём. Структуры кристаллов, принадлежащих к одному структурному типу, одинаковы до подобия. Структурный тип в кристаллографии определяет относительное расположение частиц (атомов или атомных групп) в кристалле, без указаний абсолютных расстояний между ними. Чтобы описать конкретную структуру, надо указать структурный тип и параметры структуры.
К важнейшим и распространенным структурным типам относятся: структура меди (тип А
), структура вольфрама (тип А 2
), структура магния (тип А 3
), структура алмаза (тип А 4
), структура графита (тип А 9
), структура каменной соли (тип В 1
), структура перовскита (тип Е 2
), структура шпинели (тип Н 11
).
Тип А
(Структура меди)
В структурном типе меди кристаллизуются очень многие металлы: золото, серебро, никель, алюминий, кальций, торий, свинец и др. Все эти металлы сравнительно мягкие, пластичные, легко обрабатываются. Многие из них образуют непрерывные ряды твердых растворов, например, Ag-Au, Cu-Au. Структурой типа меди обладают также интерметаллические соединения AuSb, Au 2 Bi, Au 2 Pb, Cu 2 Mg, Bi 2 K, ZrH, TiH и др.
Элементарная ячейка меди - кубическая, гранецентрированная. Атомы располагаются в вершинах и центрах граней F -ячейки. На элементарную ячейку приходится 4 атома. Каждый атом окружен 12 ближайшими атомами, координационное число (к.ч.) =12. Координационный многогранник - кубооктаэдр. В структуре имеется одна правильная система точек с кратностью 4. Плотнейшие слои 1 перпендикулярны направлениям. Плотнейшая упаковка кубическая трехслойная....АВСАВС....Пространственная группа Fm3m.
Тип А 2
(Структура вольфрама)
К структурному типу вольфрама (тип ОЦК-металлов) относятся тугоплавкие металлы: хром, ванадий, молибден, ниобий, тантал, -кобальт, -железо, титан, цирконий, гафний, щелочные элементы - литий, натрий, калий, рубидий, цезий, щелочноземельные - кальций, стронций, барий, актиниды - уран, нептуний, плутоний. Из интерметаллических соединений в ОЦК-структуре кристаллизуются AgZn, Cu 3 Al, CoAl, Cu 5 Sn, LiAg, LiAl, TaH и др.
В объемно-центрированной кубической ячейке вольфрама атомы располагаются по вершинам и в центре ячейки, т.е. на одну ячейку приходится два атома. ОЦК-структура не является плотнейшей упаковкой атомов. Коэффициент компактности равен 0,68. Пространственная группа вольфрама Im3m.
Тип А3
(Структура магния)
В структурном типе магния кристаллизуются гексагональные металлы: кадмий, бериллий, таллий, титан, никель, хром и др. Эта структура также характерна для интерметаллических соединений AgCd, AgCd 3 , AuCd, AuCd 3 , CuCd 3 , AgZn 3 , AuZn 3 , NiMo, TiH, W 2 С и др.
Элементарная ячейка магния - элементарная примитивная. Центры атомов располагаются по вершинам правильных шестиугольников: в трех вершинах - через одну, - атомы верхнего слоя, в трех других вершинах - атомы нижнего слоя. Элементарная ячейка построена на трех трансляциях, две из которых лежат в плотно упакованном слое атомов и составляют между собой угол = 120 о, третья перпендикулярна этому слою. Элементарную ячейку можно разделить плоскостью на две тригональные призмы. В центре одной из призм расположен атом, другая свободна, заселенные и пустые призмы чередуются между собой. На элементарную ячейку приходится два атома магния.
Каждый атом магния окружен двенадцатью ближайшими атомами: шестью - в том же слое, тремя в соседнем слое сверху и тремя в соседнем слое снизу, к.ч.=12. Плотные слои - плоскости базиса (0001), упаковка гексагональная, двухслойная....АВАВАВАВ.... Кристаллы металлов с плотно упакованной гексагональной структурой легче всего деформируются по плоскостям (0001) и направлениям, соответствующим наиболее плотной упаковке атомов. Координационный многогранник - гексагональный кубооктаэдр. Пространственная группа магния Р63/mmc.
Плотность упаковки – это доля объема кристаллической решетки, занятая атомами.
Кратчайшее расстояние между центрами двух шаров в элементарной ячейке равно двум радиусам шара – 2r. Объем шара V = 4/3r 3 , объем шаров, входящих в элементарную ячейку, V n = 4/3nr 3 , где n – кратность элементарной ячейки. Если объем элементарной ячейки V 0 , то плотность упаковки равна Р = (V n /V 0)·100 %.
Если период решетки равен а, то V 0 = а 3 , решение задачи сводится к выражению атомного радиуса через период решетки, для конкретной структуры следует определить кратчайшее межатомное расстояние, например, в алмазе 2r = a /4 (кратчайшее расстояние, равное двум атомным радиусам, составляет четверть пространственной диагонали куба).
В табл. 2.3 приведены результаты расчета плотности упаковки для различных структур.
Таблица 2.3
Плотность упаковки для различных структур
|
Тип решетки |
К. ч. |
Атомный радиус r |
Кратность ячейки n | |
|
Кубическая примитивная | ||||
С повышением координационного числа плотность упаковки растет.
Заполнение междоузлий в ГЦК решетке, что соответствует повышению кратности элементарной ячейки, приводит к менее плотным упаковкам.
2.8. Связь между типом структуры, координационным числом и электрофизическими свойствами
Плотнейшие и плотные упаковки (Р = 68 – 74 %) с к.ч. 8/8 и 12/12 типичны для металлов (структуры ОЦК, ГЦК, ГПУ) .
Наименее плотные упаковки (Р = 34 % и подобными) с к.ч. 4/4 (структуры алмаза, сфалерита, вюрцита), 4/2 (куприт), 2/2 (селен) типичны для полупроводников.
Структуры с промежуточными значениями к.ч. 6/6 и плотности Р 67 %, например, типаNaCl, могут иметь и проводниковые свойства (TiO, TiN, VN, TiC и др.), и полупроводниковые свойства (PbS, PbSe, PbTe), и диэлектрические (NaCl, MgO, CaO, BaO).
Металлические вещества могут кристаллизоваться и в структуры с низкими к.ч., например, в графите к.ч. равно 4, как и в алмазе.
Важнейшие полупроводники образуют следующие структуры:
алмаза: Si,Ge, α-Sn;
сфалерита: ZnS, HgS, CdTe, AlP, AlAs, AlSb, GaP, GaAs, GaSb, InP, InAs, InSb, SiC, ZnSe, HgSe, ZnTe, HgTe;
куприта: Cu 2 O, Ag 2 O;
флюорита: Mg 2 Si, Mg 2 Ge;
вюрцита: ZnS, ZnO, CdS, CdSe;
хлорида натрия: PbS, PbSe, PbTe;
арсенида никеля: VS, VSe, FeS, FeSe.
2.9. Островные, цепные и слоистые структуры
Кроме координационных структур, в которых межатомные расстояния между всеми структурными единицами одинаковы (один тип связи), в островных, цепных и слоистых структурах (рис.2.15) могут быть выделены группы атомов, которые образуют «острова» (молекулы), непрерывно простирающиеся в одном направлении (цепи), или бесконечные в двух (слои) или трех (каркасы) измерениях. Такие структуры являются молекулярными.
На рис. 2.15 а изображены островные структуры: 1 - линейные, 2 – двумерные (квадрат), 3 – трехмерные (тетраэдр). На рис. 2.15 b показаны цепные структуры: 4 – линейная, 5 – цигзагообразная, 6 и 7 – звенья из октаэдров и тетраэдров.

Рис.2.15. Островные и цепные структуры
Контрольные вопросы
Какая решетка называется простой, сложной?
Чем поликристалл отличается от монокристалла?
Что обозначает запись: (hkl), {hkl}, < hkl>, ?
Какие значения могут принимать индексы Миллера?
Запишите индексы Миллера плоскостей, перпендикулярных ребрам куба.
Запишите индексы Миллера плоскостей, перпендикулярных диагоналям граней куба.
Запишите индексы Миллера плоскостей, параллельным граням куба.
Запишите индексы Миллера направлений, перпендикулярных граням куба.
В чем отличие (110), {110 }, < 110>, ?
Какое явление называется полиморфизмом?
Что такое изоморфизм?
Чем отличается строение стекол от строения кристаллов?
Каковы особенности строения аморфных тел?
Какие структуры относятся к плотным упаковкам? Как расположены в них атомы?
В чем отличие ГПУ от ГЦК?
Чему равны координационные числа в плотных упаковках?
Где расположены тетраэдрические междоузлия в ГЦК решетке?
Где расположены октаэдрические междоузлия в ГЦК решетке?
Что называется политипизмом?
Что называется кратностью элементарной ячейки?
Чем отличаются различные типы кубических структур?
Изобразите элементарные ячейки меди, кремния, NaCl, CsCl, сфалерита.
Поясните расположение атомов в решетке вюрцита.
На основе какой плотной упаковки строится решетка вюрцита?
На основе какой плотной упаковки строится решетка сфалерита?
Сколько атомов приходится на элементарную ячейку вюрцита?
Как рассчитывается плотность упаковки кристаллических структур?
Какие кристаллические решетки имеют максимальную плотность упаковки?
Какие кристаллические решетки имеют минимальную плотность упаковки?
Как связана плотность упаковки с координационным числом?
Можно ли отнести цепные структуры к координационным? Почему?
В чем разница между дальним и ближним порядком в твердых телах?