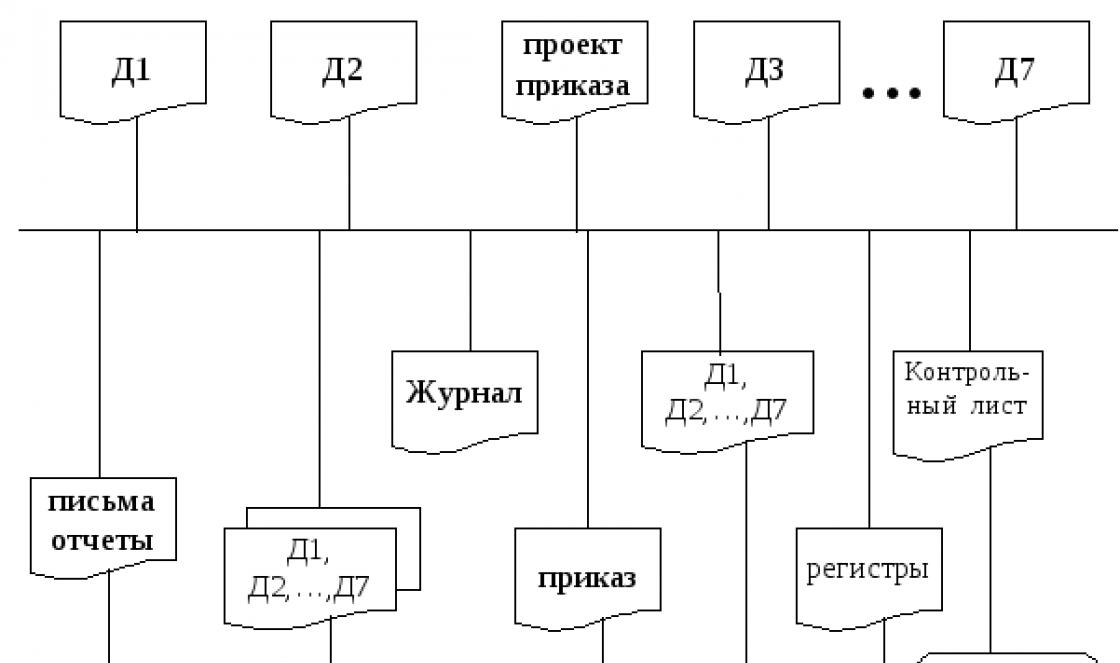
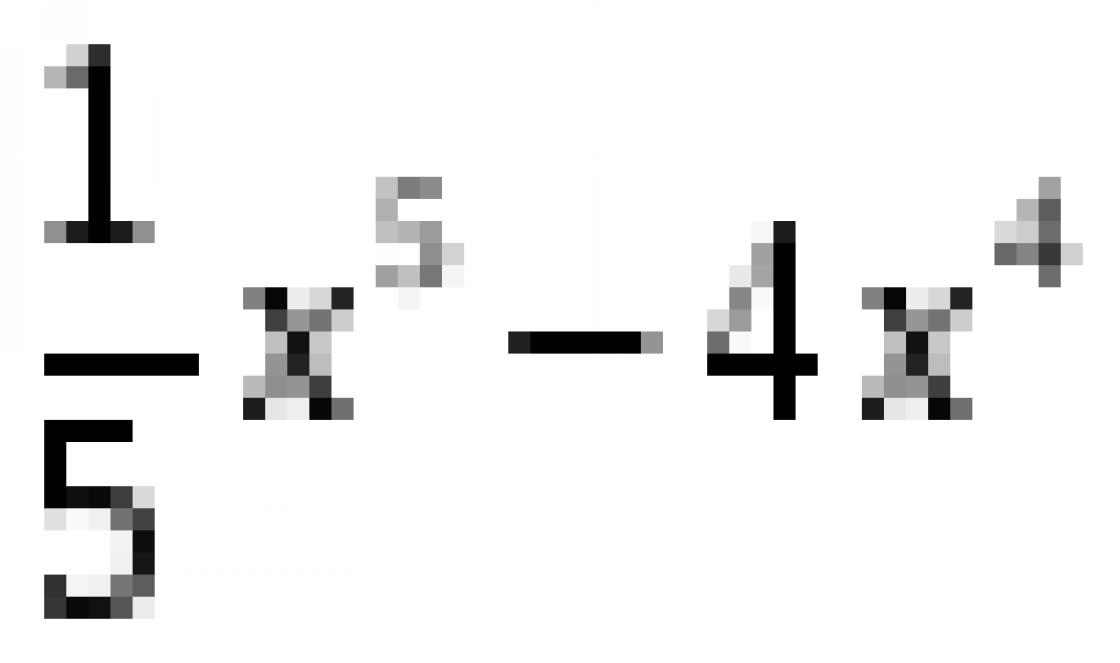Магний (лат. Magnesium), Mg, химический элемент II группы периодической системы Менделеева, атомный номер 12, атомная масса 24,305. Природный Магний состоит из трех стабильных изотопов: 24 Mg (78,60%), 25 Mg (10,11%) и 26 Mg (11,29%). Магний открыт в 1808 году Г. Дэви, который подверг электролизу с ртутным катодом увлажненную магнезию (давно известное вещество); Дэви получил амальгаму, а из нее после отгонки ртути - новый порошкообразный металл, названный магнием. В 1828 году французский химик А. Бюсси восстановлением расплавленного хлорида Магния парами калия получил Магний в виде небольших шариков с металлическим блеском.
Распространение Магния в природе. Магний - характерный элемент мантии Земли, в ультраосновных породах его содержится 25,9% по массе. В земной коре Магния меньше, средний кларк его 1,87%; преобладает Магний в основных породах (4,5%), в гранитах и других кислых породах его меньше (0,56%). В магматических процессах Mg 2+ - аналог Fe 2+ , что объясняется близостью их ионных радиусов (соответственно 0,74 и 0,80 Å). Mg 2+ вместе с Fe 2+ входит в состав оливина, пироксенов и других магматических минералов.
Минералы Магния многочисленны - силикаты, карбонаты, сульфаты, хлориды и другие. Более половины из них образовались в биосфере - на дне морей, озер, в почвах и т. д.; остальные связаны с высокотемпературными процессами.
В биосфере наблюдается энергичная миграция и дифференциация Магния; здесь главная роль принадлежит физико-химическим процессам - растворению, осаждению солей, сорбции Магний глинами. Магний слабо задерживается в биологическом круговороте на континентах и с речным стоком поступает в океан. В морской воде в среднем 0,13% Магния - меньше, чем натрия, но больше всех других металлов. Морская вода не насыщена Магнием и осаждения его солей не происходит. При испарении воды в морских лагунах в осадках вместе с солями калия накапливаются сульфаты и хлориды Магния. В илах некоторых озер накапливается доломит (например, в озере Балхаш). В промышленности Магний получают в основном из доломитов, а также из морской воды.
Физические свойства Магния. Компактный Магний - блестящий серебристо-белый металл, тускнеющий на воздухе вследствие образования на поверхности окисной пленки. Магний кристаллизуется в гексагональной решетке, а = 3,2028Å, с = 5,1998Å. Атомный радиус 1,60Å, ионный радиус Mg 2+ 0,74Å. Плотность Магния 1,739 г/см 3 (20 °С); t пл 651 °С; t кип 1107 °С. Удельная теплоемкость (при 20 °С) 1,04·10 3 дж/(кг·К), то есть 0,248 кал/(г·°С); теплопроводность (20 °С) 1,55·10 2 вт/(м·К), то есть 0,37 кал/(см·сек·°С); термический коэффициент линейного расширения в интервале 0-550 °С определяется из уравнения 25,0·10 -6 + 0,0188 t. Удельное электрическое сопротивление (20 °С) 4,5·10 -8 ом·м (4,5 мком·см). Магний парамагнитен, удельная магнитная восприимчивость +0,5·10 -6 , Магний - относительно мягкий и пластичный металл; его механические свойства сильно зависят от способа обработки. Например, при 20 °С свойства соответственно литого и деформированного Магния характеризуются следующими величинами: твердость по Бринеллю 29,43·10 7 и 35,32·10 7 н/м 2 (30 и 36 кгс/мм 2), предел текучести 2,45·10 7 и 8,83·10 7 н/м 2 (2,5 и 9,0 кгс/мм 2), предел прочности 11,28·10 7 и 19,62·10 7 н/м 2 (11,5 и 20,0 кгс/мм 2), относительное удлинение 8,0 и 11,5%.
Химические свойства Магния. Конфигурация внешних электронов атома Магния 3s 2 . Во всех стабильных соединениях Магний двухвалентен. В химическом отношении Магний - весьма активный металл. Нагревание до 300-350 °С не приводит к значительному окислению компактного Магния, так как поверхность его защищена оксидной пленкой, но при 600-650 °С Магний воспламеняется и ярко горит, давая оксид магния и отчасти нитрид Mg 3 N 2 . Последний получается и при нагревании Магния около 500 °С в атмосфере азота. С холодной водой, не насыщенной воздухом, Магний почти не реагирует, из кипящей медленно вытесняет водород; реакция с водяным паром начинается при 400 °С. Расплавленный Магний во влажной атмосфере, выделяя из Н 2 О водород, поглощает его; при застывании металла водород почти полностью удаляется. В атмосфере водорода Магний при 400-500 °С образует MgH 2 .
Магний вытесняет большинство металлов из водных растворов их солей; стандартный электродный потенциал Mg при 25 °С - 2,38 в. С разбавленными минеральными кислотами Магний взаимодействует на холоду, но в плавиковой кислоте не растворяется вследствие образования защитной пленки из нерастворимого фторида MgF 2 . В концентрированной H 2 SО 4 и смеси ее с НNО 3 Магний практически нерастворим. С водными растворами щелочей на холоду Магний не взаимодействует, но растворяется в растворах гидрокарбонатов щелочных металлов и солей аммония. Едкие щелочи осаждают из растворов солей гидрооксид Магния Mg(OH) 2 , растворимость которой в воде ничтожна. Большинство солей Магния хорошо растворимо в воде, например сульфат магния, мало растворимы MgF 2 , MgCО 3 , Mg 3 (PO 4) 2 и некоторые двойные соли.
При нагревании Магний реагирует с галогенами, давая галогениды; с влажным хлором уже на холоду образуется MgCl 2 . При нагревании Магний до 500-600 °С с серой или с SO 2 и H 2 S может быть получен сульфид MgS, с углеводородами - карбиды MgC 2 и Mg 2 C 3 . Известны также силициды Mg 2 Si, Mg 3 Si 2 , фосфид Mg 3 P 2 и других бинарные соединения. Магний - сильный восстановитель; при нагревании вытесняет другие металлы (Be, Al, щелочные) и неметаллы (В, Si, С) из их оксидов и галогенидов. Магний образует многочисленные металлоорганические соединения, определяющие его большую роль в органических синтезе. Магний сплавляется с большинством металлов и является основой многих технически важных легких сплавов.
Получение Магния. В промышленности наибольшее количество Магния получают электролизом безводного хлорида MgCl 2 или обезвоженного карналлита KCl·MgCl 2 ·6H 2 O. В состав электролита входят также хлориды Na, К, Са и небольшое количество NaF или CaF 2 . Содержание MgCl 2 в расплаве - не менее 5-7%; по мере хода электролиза, протекающего при 720-750 °С, проводят корректировку состава ванны, удаляя часть электролита и добавляя MgCl 2 или карналлит. Катоды изготовляют из стали, аноды - из графита. Расплавленный Магний, всплывающий на поверхность электролита, периодически извлекается из катодного пространства, отделенного от анодного перегородкой, не доходящей до дна ванны. В состав чернового Магния входят до 2% примесей; его рафинируют в тигельных электрических печах под слоем флюсов и разливают в изложницы. Лучшие сорта первичного Магния содержат 99,8% Mg. Последующая очистка Магния проводится сублимацией в вакууме: 2-3 сублимации повышают чистоту Магний до 99,999%. Анодный хлор после очистки используется для получения безводного MgCl 2 из магнезита, тетрахлорида титана TiCl 4 из оксида ТiO 2 и других соединений.
Другие способы получения Магния - металлотермический и углетермический. По первому брикеты из прокаленного до полного разложения доломита и восстановителя (ферросилиция или силикоалюминия) нагревают при 1280-1300°С в вакууме (остаточное давление 130-260 н/м 2 , т.е. 1-2 мм рт.ст.). Пары Магния конденсируют при 400-500 °С. Для очистки его переплавляют под флюсом или в вакууме, после чего разливают в изложницы. По углетермическому способу брикеты из смеси угля с окисью Магний нагревают в электропечах выше 2100 °С; пары Магния отгоняют и конденсируют.
Применение Магния. Важнейшая область применения металлического Магния - производство сплавов на его основе. Широко применяют Магний в металлотермических процессах получения трудновосстанавливаемых и редких металлов (Ti, Zr, Hf, U и других), используют Магний для раскисления и десульфурации металлов и сплавов. Смеси порошка Магния с окислителями служат как осветительные и зажигательные составы. Широкое применение находят соединения Магния.
Магний в организме. Магний - постоянная часть растительных и животных организмов (в тысячных - сотых долях процента). Концентраторами Магния являются некоторые водоросли, накапливающие до 3% Магний (в золе), некоторые фораминиферы - до 3,5%, известковые губки - до 4% . Магний входит в состав зеленого пигмента растений - хлорофилла (в общей массе хлорофилла растений Земли содержится около 100 млрд. т Магний), а также обнаружен во всех клеточных органеллах растений и рибосомах всех живых организмов. Магний активирует многие ферменты, вместе с кальцием и марганцем обеспечивает стабильность структуры хромосом и коллоидных систем в растениях, участвует в поддержании тургорного давления в клетках. Магний стимулирует поступление фосфора из почвы и его усвоение растениями, в виде соли фосфорной кислоты входит в состав фитина. Недостаток Магния в почвах вызывает у растений мраморность листа, хлороз растений (в подобных случаях используют магниевые удобрения). Животные и человек получают Магний с пищей. Суточная потребность человека в Магнии - 0,3-0,5 г; в детском возрасте, а также при беременности и лактации эта потребность выше. Нормальное содержание Магния в крови - примерно 4,3 мг%; при повышенном содержании наблюдаются сонливость, потеря чувствительности, иногда паралич скелетных мышц. В организме Магний накапливается в печени, затем значительная его часть переходит в кости и мышцы. В мышцах Магний участвует в активировании процессов анаэробного обмена углеводов. Антагонистом Магния в организме является кальций. Нарушение магниево-кальциевого равновесия наблюдается при рахите, когда Магний из крови переходит в кости, вытесняя из них кальций. Недостаток в пище солей Магния нарушает нормальную возбудимость нервной системы, сокращение мышц. Крупный рогатый скот при недостатке Магния в кормах заболевает так называемой травяной тетанией (мышечные подергивания, остановка роста конечностей). Обмен Магния у животных регулируется гормоном паращитовидных желез, понижающим содержание Магний в крови, и проланом, повышающим содержание Магния. Из препаратов Магния в медицинской практике применяют: сульфат Магния (как успокаивающее, противосудорожное, спазмолитическое, слабительное и желчегонное средство), магнезию жженую (магния оксид) и карбонат Магния (как щелочи, легкое слабительное).
Соединения магния были известны человеку с давних пор. Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита. Металлический магний впервые получил в 1808 английский химик Г. Дэви. Магний, полученный Дэви, был довольно грязным, чистый металлический магний получен впервые в 1828 французским химиком А. Бюсси.
Нахождение в природе, получение:
Магний - один из десяти наиболее распространенных элементов земной коры. В ней содержится 2,35% магния по массе. Из-за высокой химической активности в свободном виде магний не встречается, а входит в состав множества минералов - силикатов, алюмосиликатов, карбонатов, хлоридов, сульфатов и др. Так, магний содержат широко распространенные силикаты оливин (Mg,Fe) 2 и серпентин Mg 6 (OH) 8 .
Важное практическое значение имеют такие магнийсодержащие минералы, как асбест, магнезит, доломит
MgCO 3 CaCO 3 , бишофит
MgCl 2 6H 2 O, карналлит
KCl MgCl 2 6H 2 O, эпсомит MgSO 4 7H 2 O, каинит KCl MgSO 4 3H 2 O, астраханит Na 2 SO 4 MgSO 4 4H 2 O и др.
Магний содержится в морской воде (4% Mg в сухом остатке), в природных рассолах, во многих подземных водах.
Обычный промышленный метод получения металлического магния - это электролиз расплава смеси безводных хлоридов магния MgCl 2 , натрия NaCl и калия KCl. В этом расплаве электрохимическому восстановлению подвергается хлорид магния.
Другой способ получения магния - термический. В этом случае для восстановления оксида магния при высокой температуре используют кокс или кремний. Применение кремния позволяет получать магний из такого сырья, как доломит CaCO 3 ·MgCO 3 , не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции:
CaCO 3 ·MgCO 3 = CaO + MgO + 2CO 2 ,
2MgO + 2CaO + Si = Ca 2 SiO 4 + 2Mg.
Для получения магния используют не только минеральное сырье, но и морскую воду. Чистота рафинированного магния достигает 99,999% и выше.
Физические свойства:
Магний - серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. Плотность магния??? г/см 3 , он почти в 5 раз легче меди, в 4,5 раза легче железа; даже алюминий в 1,5 раза тяжелее магния. Температура плавления???°C, температура кипения???°C.
Химические свойства:
Отношение к воздуху и кислороду при обычных условиях: ...
При нагревании: ...
С холодной водой магний почти не взаимодействует, но при нагревании разлагает ее с выделением водорода. В этом отношении он занимает промежуточное положение между бериллием, который вообще с водой не реагирует и кальцием, легко с ней взаимодействующим.
В электрохимическом ряду напряжений магний стоит значительно левее водорода и активно реагирует с разбавленными кислотами с образованием солей. В этих реакциях есть у магния особенности. Он не растворяется во фтороводородной, концентрированной серной и в смеси серной и в смеси азотной кислот, растворяющей другие металлы почти столь же эффективно, как "царская водка" (смесь HCl и HNO 3). Не взаимодействует с растворами щелочей.
Важнейшие соединения:
Оксид магния, MgO
: ???.
При хранении на воздухе оксид магния постепенно поглощает влагу и CO 2 , переходя в Mg(OH) 2 и в MgCO 3
Пероксид магния, MgO 2
: получен взаимодействием свежеосажденной Mg(OH) 2 с 30%-ной H 2 O 2 .
Бесцветное микрокристаллическое вещество, малорастворимое в воде и постепенно разлагающееся при хранении на воздухе.
Гидроксид магния, Mg(OH) 2
: белый, очень малорастворим в воде. Помимо кислот, он растворим в растворах солей аммония (что важно для аналитической химии). Встречается в природе (минерал брусит).
Соли магния
. Большинство солей магния хорошо растворимо в воде. Растворы содержат бесцветные ионы Mg 2+ , которые сообщают жидкости горький вкус. Заметно гидролизуются водой только при нагревании раствора.
Большинство солей выделяется из растворов в виде кристаллогидратов (напр. MgCl 2 *6H 2 O, MgSO 4 *7H 2 O). MgSO 4 *7H 2 O в природе образует минерал "горькая соль
".
При нагревании кристаллогидратов галоидных солей образуются труднорастворимые в воде основные соли.
К малорастворимым солям магния относится MgF 2 (растворимость 0,08г/л), карбонат магния. Последний может быть получен реакцией обмена только при одновременном присутствии в растворе большого избытка CO 2 , в противном случае осаждаются основные соли. Примером такой соли может служить "белая магнезия
" - основная соль приблизительного состава 3MgCO 3 *Mg(OH) 2 *3H 2 O
Применение:
Основная часть добываемого магния используется для получения различных легких сплавов. В состав этих сплавов, кроме магния, входят, как правило, алюминий, цинк, цирконий. Такие сплавы достаточно прочны и находят применение в самолетостроении, приборостроении и для других целей.
Для защиты от коррозии водонагревателей и отопительных котлов находят применение магниевые аноды, представляющие из себя стальные стержни с нанесенным на них слоем магниевого сплава. В этом случае разрушается сам анод, а не стенки водонагревателя (протекторная защита).
Высокая химическая активность металлического магния позволяет использовать его при магниетермическом получении таких металлов, как титан, цирконий, ванадий, уран и др. При этом магний реагирует с оксидом или фторидом получаемого металла, например:
2Mg + TiO 2 = 2MgO + Ti или 2Mg + UF 4 = 2MgF 2 + U.
Широкое применение находят многие соединения магния, особенно его оксид, карбонат и сульфат. Так, горькая соль применяется в текстильной и бумажной промышленности, а также в медицине.
В человеческом организме количество магния составляет всего несколько десятых или сотых долей процента, однако он играет немаловажную роль в процессах жизнедеятельности. Магний усиливает процессы обмена углеводов в мышцах, регулирует обмен кальция; поэтому из-за недостатка магния развивается остеопороз и воспалительно-дистрофические заболевания опорно-двигательного аппарата.
Недостаточное количество магния в крови - признак переутомления или стрессового состояния. Доказано, что недостаток магния в организме способствует заболеванию инфарктом миокарда. В организм поступает с пищей, но при этом усваивается менее 40% магния, так как его соединения плохо всасываются кишечником.
Основным производителем этого металла в мире является Китай, который «монополизировал» мировой рынок. В 2007 году производство китайского магния достигло 260 тысяч тонн. В России производство сосредоточено в Пермском крае (25 тыс.т/год). В 2004 году создано ОАО «Русский магний» для строительства завода по производству магния в Асбесте (Свердловская область), но в настоящее время проект заморожен.
Алиуллов Андрей
ХФ ТюмГУ, 581 группа, 2011 г.
| Магний | |
|---|---|
| Атомный номер | 12 |
| Внешний вид простого вещества |
лёгкий, ковкий, серебристо-белый металл |
| Свойства атома | |
|
Атомная масса (молярная масса) |
24,305 а. е. м. ( /моль) |
| Радиус атома | 160 пм |
|
Энергия ионизации (первый электрон) |
737,3 (7,64) кДж/моль (эВ) |
| Электронная конфигурация | 3s 2 |
| Химические свойства | |
| Ковалентный радиус | 136 пм |
| Радиус иона | 66 (+2e) пм |
|
Электроотрицательность (по Полингу) |
1,31 |
| Электродный потенциал | −2,37 В |
| Степени окисления | 2 |
| Термодинамические свойства простого вещества | |
| Плотность | 1,738 г/см³ |
| Молярная теплоёмкость | 24,90 Дж/(K·моль) |
| Теплопроводность | 156 Вт/(м·K) |
| Температура плавления | 922 K |
| Теплота плавления | 9,20 кДж/моль |
| Температура кипения | 1 363 K |
| Теплота испарения | 131,8 кДж/моль |
| Молярный объём | 14,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,210 c=5,21 Å |
| Отношение c/a | 1,624 |
| Температура Дебая | 318 K |
| Mg | 12 |
| 24,305 | |
| 3s 2 | |
| Магний | |
Магний — элемент главной подгруппы второй группы, третьего периода периодической системы химических элементов, с атомным номером 12. Обозначается символом Mg Magnesium. Простое вещество магний (CAS-номер: 7439-95-4) — лёгкий, ковкий металл серебристо-белого цвета.
История
Происхождение названия
В 1695 году из минеральной воды Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и слабительным действием. Аптекари называли её горькой солью, а также английской, или эпсомской солью. Минерал эпсомит имеет состав MgSO 4 · 7H 2 O.
Впервые был выделен в чистом виде сэром Хемфри Дэви в 1808 году.
Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl 2 (бишофит), натрия NaCl и калия KCl. В этом расплаве электрохимическому восстановлению подвергается хлорид магния:
MgCl 2 (электролиз) = Mg + Cl 2 .
Расплавленный металл периодически отбирают из электролизной ванны, а в нее добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много — около 0,1 % примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые «отнимают» примеси от магния, или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кокс:
или кремний. Применение кремния позволяет получать магний из такого сырья, как доломит CaCO 3 ·MgCO 3 , не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции:
CaCO 3 ·MgCO 3 = CaO + MgO + 2CO 2 ,
2MgO + CaO + Si = Ca 2 SiO 4 + 2Mg.
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырье, но и морскую воду.
Физические свойства
Магний — очень легкий, довольно хрупкий металл, постепенно окисляется на воздухе, превращаясь в белый оксид магния. Кристаллическая решетка α-формы Ca (устойчивой при обычной температуре) гранецентрированная кубическая, а = 5,56Å. Атомный радиус 1,97Å, ионный радиус Ca2+, 1,04Å. Плотность 1,74 г/см³(20 °C). Выше 464 °C устойчива гексагональная β-форма. t пл = 650 °C, t кип = 1105 °C; температурный коэффициент линейного расширения 22.10-6 (0-300 °C); теплопроводность при 20 °C 125,6 Вт/(м.К) или 0,3 кал/(см.сек.°C); удельная теплоемкость (0-100 °C) 623,9 дж/(кг.К) или 0,149 кал/(г.°C); удельное электросопротивление при 20 °C 4,6.10-8 ом.м или 4,6.10-6ом.см; температурный коэффициент электросопротивления 4,57.10-3 (20 °C). Модуль упругости 26 Гн/м² (2600 кгс/мм²); предел прочности при растяжении 60 Мн/м² (6 кгс/мм²); предел упругости 4 Мн/м² (0,4 кгс/мм²), предел текучести 38 Мн/м² (3,8 кгс/мм²); относительное удлинение 50 %; твердость по Бринеллю 200—300 Мн/м² (20-30 кгс/мм²). Магний достаточно высокой чистоты пластичен, хорошо прессуется, прокатывается и поддается обработке резанием.
Химические свойства
Смесь порошкового магния с перманганатом калия KMnO 4 — взрывчатое вещество! Раскаленный магний реагирует с водой:
Mg (раск.) + Н 2 О = MgO + H 2 ;
Щелочи на магний не действуют, в кислотах он растворяется легко с выделением водорода:
Mg + 2HCl = MgCl 2 + H 2 ;
При нагревании на воздухе магний сгорает, с образованием оксида, также с азотом может образовываться небольшое количество нитрида:
2Mg + О 2 = 2MgO;
3Mg + N 2 = Mg 3 N 2
Определение
Серебристо-белый, средний по твердости металл. Средне распространен в природе. При горении выделяется большое количество света и тепла.
Применение
Сплавы
Сплавы на основе магния являются важным конструкционным материалом в авиационной и автомобильной промышленности благодаря их лёгкости и прочности. Цены на магний в слитках в 2006 году составили в среднем 3 долл/кг.
Химические источники тока
Магний в виде чистого металла, а так же его химические соединения (бромид, перхлорат) применяются для производства очень мощных резервных электрических батарей (например магний-перхлоратный элемент, серно-магниевый элемент, хлористосвинцово-магниевый элемент, хлорсеребряно-магниевый элемент, хлористомедно-магниевый элемент, магний-ванадиевый элемент и др), и сухих элементов (марганцево-магниевый элемент, висмутисто-магниевый элемент, магний-м-ДНБ элемент и др). ХИТ на основе магния отличаются очень высокими значениями удельных энергетических характеристик и высоким разрядным напряжением. В последние годы в ряде стран обострилась проблема разработки аккумулятора с большим сроком службы, так как теоретические данные позволяют утверждать очень большие перспективы его широкого использования (высокая энергия, экологичность, доступность сырья).
Соединения
Гидрид магния — один из наиболее емких аккумуляторов водорода, применяемых для его хранения.
Огнеупорные материалы
Оксид магния MgO применяется в качестве огнеупорного материала для производства тиглей и специальной футеровки металлургических печей.
Перхлорат магния, Mg(ClO 4) 2 — (ангидрон) применяется для глубокой осушки газов в лабораториях, и в качестве электролита для химических источников тока с участием магния.
Фторид магния MgF 2 — в виде синтетических монокристаллов применяется в оптике (линзы, призмы).
Бромид магния MgBr 2 — в качестве электролита для химических резервных источников тока.
Медицина
Оксид и соли магния применяется в медицине (аспаркам, сульфат магния, цитрат магния, минерал бишофит). Бишофитотерапия использует биологические эффекты природного магния в лечении и реабилитации широкого круга заболеваний, в первую очередь — опорно-двигательного аппарата, нервной и сердечно-сосудистой систем.
Фотография
Магниевый порошок с окисляющими добавками (нитрат бария, нитрат аммония, перманганат калия, гипохлорит натрия, хлорат калия и т. д.) применялся (и применяется сейчас в редких случаях) в фотоделе в химических фотовспышках (магниевая фотовспышка).
Биологическая роль и токсикология
Магний — один из важных биогенных элементов, в значительных количествах содержится в тканях животных и растений. Магний является кофактором многих ферментативных реакций. Магний необходим для превращения креатина фосфата в АТФ — нуклеотид, являющийся универсальным поставщиком энергии в живых клетках организма. Поэтому магний является тем элементом, который контролирует энергетику организма. Магний необходим на всех этапах синтеза белка. Установлено также, что 80—90 % современных людей страдают от дефицита магния. Это может проявляться по-разному: бессоница, хроническая усталость, остеопороз, артрит, фибромиалгия, мигрень, мышечные судороги и спазмы, сердечная аритмия, запоры, предменструальный синдром (ПМС) и прочие симптомы и болезни. А при частом употреблении слабительных, алкоголя, больших психических и физических нагрузках потребность в магнии увеличивается.
К пище, богатой магнием, относятся: кунжут, отруби, орехи. Магния совсем мало в хлебе, молочных, мясных и других повседневных продуктах питания современного человека. Для получения суточной нормы магния, порядка 300 мг для женщин и 400 мг для мужчин, необходимо выпивать 2—3 литра молока или съедать 1,5—2 кг мяса.
По результатам последних исследований обнаружено, что цитрат магния является наиболее усваиваемым магниесодержащим продуктом.
Установлено, что чтобы усвоить кальций, организму необходим магний. Одним из наиболее биологически целесообразных источников магния при транскутанном (чрезкожном) всасывании является минерал бишофит, широко использующийся в целях медицинской реабилитации, физиотерапии и санаторно-курортного лечения.
Магний, Magnesium, Mg (12)
Название магнезия встречается уже в Лейденском папирусе-Х (Ш в.). Оно происходит, вероятно, от названия города в гористой местности Фессалии — Магнисия. Магнесийским камнем в древности назывались магнитная окись железа, а магнесом — магнит. Эти названия перешли в латинский и другие языки.
Внешнее сходство магнитной окиси железа с пиролизитом (двуокисью марганца) привело к тому, что магнезийским камнем, магнетисом и магне стали называть минералы и руды темной и темно-коричневой окраски, а в дальнейшем и другие минералы. В алхимической литературе слово магнес (Magnes) обозначало многие вещества, например ртуть, эфиопский камень, гераклийский камень. Минералы, rдержащие магний, тоже были известны с глубокой древности (доломит, тальк, асбест, нефрит и др.) и уже тогда находили широкое применение. Однако их считали не индивидуальными веществами, а видоизменениями других, более известных минералов, чаще всего извести.
Установить тот факт, что в магнийсодержащих минералах и солях присутствует особое металлическое основание, помогли исследования минеральной воды Эпсомского источника в Англии, открытого в 1618 г. Твердую соль из горькой эпсомской воды выделил в 1695 г. Грю, указав при этом, что по своей природе эта соль заметно отличается от всех других солей. В XVIII в. эпсомской солью занимались многие видные химики-аналитики — Бергман, Нейман, Блэк и др. Когда в континентальной Европе были открыты источники воды, подобной эпсомской, эти исследования расширились еще больше. По-видимому, Нейман первым предложил называть эпсомскую соль (карбонат магния) белой магнезией в отличие от черной магнезии (пиролюзита). Земля белой магнезии (Magnesia alba) под названием магнезия фигурирует в списке простых тел Лавуазье, причем синонимом этой земли Лавуазье считает «основание эпсомской соли» (base de sel d"Epsom).
В русской литературе начала XIX в. магнезия именовалась иногда горькоземом. В 1808 г. Дэви, подвергая белую магнезию электролизу, получил немного нечистого металлического магния; в чистом виде этот металл был получен Бусси в 1829 г. Вначале Дэви предложил назвать новый металл магнием (Magnium) в отличие от магнезии, которая в то время обозначала металлическое основание пиролюзита (Magnesium). Однако, когда название черной магнезии было изменено, Дэви предпочел называть металл магнезием. Интересно, что первоначальное название магний уцелело только в русском языке благодаря учебнику Гесса. В начале XIX в. предлагались и другие названия — магнезь (Страхов), магнезий, горькоземий (Щеглов).
Магний – лёгкий серебристо-белый металл, блестящий, но тускнеющий на воздухе из-за образования защитной оксидной плёнки на его поверхности. Химическая формула магния – Mg. 12 - атомный номер магния в периодической системе химических элементов Д.И. Менделеева.
Магний довольно распространён в земной коре. Опережают магний в этом плане только кислород, кремний, алюминий, железо и кальций. В природе он встречается в виде соединений. Важнейшие минералы, содержащие магний – магнезит MgCO 3 и двойная соль доломит CaMg 2 . Огромные запасы магния содержатся в морях и океанах в виде MgCl 2 . Науке известно около 1500 минералов. И почти 200 из них содержат магний.
Получение магния

Как же был открыт магний?
В 1695 г. английский врач Крю проводил анализы минеральной воды из источника поблизости города Эпсом. При упаривании этой воды на стенках сосуда образовалась белая соль c горьким вкусом. Эта соль обладала лечебными свойствами. Аптекари называли эту соль английской или эпсонской. Позже соль получила название белой магнезии из-за своего сходства с белым порошком, который получали, прокаливая минерал, обнаруженный вблизи греческого города Магнезии.
Металл магний впервые удалось получить в 1808 г. британскому химику Хемфри Дэви. Дэви подвергал электролизу смесь белой магнезии и окиси ртути. В результате он получил сплав ртути и неизвестного металла. Выделив металл, Дэви предложил назвать его магнием. Но магний, полученный Дэви, содержал примеси. Чистый, без примесей, магний удалось получить только в 1829 г. французскому химику Антуану Бюсси.
Химические свойства магния

Магний – активный металл. И как все активные металлы, он хорошо горит. В обычных условиях его поверхность защищена оксидной плёнкой. Но при нагревании до 600 градусов плёнка разрушается, и магний реагирует с кислородом. Продукт горения магния – оксид магния, белый порошок.
2Mg + O 2 = 2MgO
При горении выделяется много тепла и света. Причём по своему спектральному анализу свет при горении магния почти такой же, как солнечный свет. Это свойство использовали первые фотографы более 100 лет назад. Горение магниевого порошка с добавками перманганата калия или нитрата бария освещало объект фотографирования, что позволяло делать чёткие снимки в закрытом помещении, где освещение было недостаточным.
Магний вступает в реакцию с водой только при нагревании. В результате этой реакции выделяется водород.
Mg + 2H 2 O = Mg(OH) 2 + H 2
Горит магний и в среде углекислого газа.
2Mg + C O 2 = 2MgO + C
С галогенами магний взаимодействует при комнатной температуре.
Mg + Br 2 = MgBr 2
С серой магний вступает в реакцию только при нагревании, образуя сульфид магния.
Mg + S = MgS
В реакцию со щелочами магний не вступает.
Получение магния
Металлический магний получают электротермическим или электролитическим способом.
В первом случае магнезит или доломит, находящиеся в реакционном аппарате, прокаливают. В результате получают окись магния MgO. Затем окись магния восстанавливается алюминием, кремнием или углем. Так получают чистый магний.
Но основным промышленным способом получения магния является электролитический. В специальных ваннах-электролизёрах находится расплав хлорида магния MgCl2. В результате электролиза на железном катоде выделяется магний, а на графитовом аноде собираются ионы хлора. Расплавленный магний собирают и разливают по формам. Затем магний проходит очистку от примесей.
Применение магния
Способность магния легко взаимодействовать с кислородом позволяет использовать его в производстве стали для удаления кислорода, растворённого в расплавленных металлах. Магниевый порошок применяется в ракетостроении как высококалорийное горючее. Высокоочищенный магний используют в производстве полупроводников.
Магний – самый лёгкий из металлов. Он в четыре раза легче железа и в полтора раза легче алюминия. В чистом виде магний мягкий и непрочный. Из него нельзя делать технические конструкции. Но механическая прочность магния значительно повышается, если в него добавить цинк, алюминий или марганец. Добавки вводят в небольшом количестве, чтобы не увеличить удельный вес магния. К сожалению, эти сплавы при нагревании теряют свою прочность. Но если к ним добавить цинк, медь, серебро, бериллий, торий, цирконий, титан, то они сохраняют свою механическую прочность даже при повышении температуры. Корпуса из магниевых сплавов можно обнаружить в мобильных телефонах, видеокамерах, ноутбуках. Кроме того, детали из магниевых сплавов поглощают вибрацию в 100 раз лучше алюминия и в 20 раз лучше легированной стали. Поэтому их широко применяют в авиации, автомобилестроении и других областях техники.
Магний - элемент главной подгруппы второй группы, третьего периода с атомным номером 12.
Строение атома:
1) Конфигурация электронного облака 1s 2 | 2s 2 2p 6 3s 2
2) Радиус атома 145 · 10 -12 (Метр)
3) Атомная масса 24.305 (г/моль)
Физические свойства:
1) металл серебристо-белого цвета, обладает металлическим блеском
2) пластичный и ковкий металл, хорошо прессуется, прокатывается и поддаётся обработке резанием.
3) теплопроводность при 20°C - 156 Вт/(м*К)
4) мягкий (твердость магния 2 по шкале Мооса)
5) температура кипения tкип = 1103°C
6) температура плавления металла tпл = 651°C
7) плотность магния при 20°C - 1,737 г./смі
8) цветной металл
9) проводит электричество (удельное электрическое сопротивление проводников (при 20°C) - 4.400 · 10 -8 (Ом · Метр)
10) по магнитным свойствам парамагнетик
Распространение в природе
Магний - это один из самых распространённых элементов земной коры. Главными видами нахождения магнезиального сырья являются:
морская вода - (Mg 0,12-0,13%),
карналлит - MgCl 2 * KCl * 6H 2 O (Mg 8,7%),
бишофит - MgCl 2 * 6H 2 O (Mg 11,9%),
кизерит - MgSO 4 * H 2 O (Mg 17,6%),
эпсомит - MgSO 4 * 7H 2 O (Mg 16,3%),
каинит - KCl * MgSO 4 * 3H 2 O (Mg 9,8%),
магнезит - MgCO 3 (Mg 28,7%),
доломит - CaCO 3 * MgCO 3 (Mg 13,1%),
брусит - Mg(OH) 2 (Mg 41,6%).
Магний есть в кристаллических горных породах в виде нерастворимых карбонатов или сульфатов, а также (в менее доступной форме) в виде силикатов. Оценка его общего содержания существенно зависит от используемой геохимической модели, в частности, от весовых отношений вулканических и осадочных горных пород. Сейчас используются значения от 2 до 13,3%. Возможно, наиболее приемлемым является значение 2,76%, которое по распространенности ставит магний шестым после кальция (4,66%) перед натрием (2,27%) и калием (1,84%).
Большие области суши, такие как Доломитовые Альпы в Италии состоят преимущественно из минерала доломита. Там встречаются и осадочные минералы - магнезит, эпсомит, карналлит, лангбейнит.
Залежи доломита есть во многих других районах, в том числе в Московской и Ленинградской областях. Богатые месторождения магнезита найдены на Среднем Урале и в Оренбургской области. В районе г. Соликамска разрабатывается крупнейшее месторождение карналлита. Силикаты магния представлены базальтовым минералом оливином, мыльным камнем (тальк), асбестом (хризотил) и слюдой. Шпинель относится к драгоценным камням.
Большое количество магния содержится в водах морей и океанов и в природных рассолах. В некоторых странах именно они являются сырьем для получения магния. По содержанию в морской воде из металлических элементов он уступает только натрию. В каждом кубометре морской воды содержится около 4 кг магния. Магний есть и в пресной воде, обусловливая, наряду с кальцием, ее жесткость.
Магний всегда содержится в растениях, так как входит в состав хлорофиллов.
Химические свойства:
1) конфигурация внешних электронов атома Магния 3s 2
2) во всех стабильных соединениях Магний двухвалентен
3) активный металл
4) радиус атома 145 * 10 -12 (Метр)
5) гексагональная кристаллическая решёткой
6) металлическая кристаллическая решетка
7) металлическая химическая связь
Важнейшие соединения магния и их применение.
Гидрид магния MgH 2 . Твердое белое нелетучее вещество. Мало растворим в воде. Разлагает воду и спирты. Распадается на элементы при нагревании. Образуется при взаимодействии магния с водородом при нагревании. Является одним из наиболее ёмких аккумуляторов водорода, применяемых для его хранения.
Оксид (белая магнезия, жженая магнезия) магния MgO . Встречается в природе в виде серовато-зеленых прозрачных октаэдрических кристаллов. Мало растворим в воде, растворяется в спирте, разбавленных кислотах. Можно получить, сжигая магний в кислороде, прокаливанием гидроксида или карбоната магния.
Применяется для изготовления лабораторных изделий (тиглей, лодочек, багетов, трубок для сжигания), огнеупорного кирпича, магнезиального цемента.
Гидроксид магния Mg(OH) 2 . Встречается в природе в виде белого волокнистого вещества, называемого бруситом. Бесцветные тригональные кристаллы со слоистой решеткой. Слабое основание. Растворяется в разбавленных кислотах и солях аммония. Мало растворим в воде. Обезвоживается при нагревании. В промышленности извлекается из морской воды путем осаждения известковым или доломитовым молоком. Можно получить действием гидроксидов щелочных металлов на соли магния.
Используется в качестве пищевой добавки, для связывания диоксида серы, как флокулянт для очистки сточных вод, в качестве огнезащитного средства в термопластических полимерах (полиолефины, ПВХ), как добавка в моющие средства, для получения оксида магния, рафинирования сахара, в качестве компонента зубных паст. В медицине его применяют в качестве лекарства для нейтрализации кислоты в желудке, а также как очень сильное слабительное. В Европейском союзе гидроксид магния зарегистрирован в качестве пищевой добавки E528.
Фторид магния MgF 2 . Бесцветные диамагнитные тетраэдрические кристаллы. Мало растворим в воде и ацетоне, растворяется в растворах фторидов и сульфатов щелочных металлов. Можно получить, сжигая магний в атмосфере фтора или действуя плавиковой кислотой на оксид магния.
Применяется для защиты металлов от коррозии и изготовления матового стекла и керамики.
Хлорид магния MgCl 2 . Бесцветные гексагональные кристаллы со слоистой структурой, очень гигроскопичные. Хорошо растворим в воде, спирте, пиридине, мало растворим в ацетоне. Можно получить, сжигая магний в хлоре, действуя соляной кислотой на металлический магний.
Применяется для электролитического получения металлического магния, для пропитки тканей и древесины, для производства магнезиальных цементов, а также в медицине.
Бромид магния MgBr 2 . Бесцветные гексагональные диамагнитные кристаллы. Растворяется в воде, спирте. Легко присоединяет аммиак, пиридин и этилендиамин. Получают взаимодействием магния и брома при нагревании.
Применяется для получения элементарного брома, бромида серебра и других мало растворимых в воде бромидов.
Иодид магния MgI 2 . Бесцветные кристаллы, очень гигроскопичные. Легко растворяется в воде, спирте, эфире. Получают непосредственным взаимодействием магния и йода или реакцией между хлоридом магния и иодидом аммония.
Используется в некоторых гомеопатических препаратах.
Сульфид магния MgS. Бесцветные кубические кристаллы. Мало растворим в воде. Реагирует с галогенами. Разлагается разбавленными кислотами с образованием солей и выделением сероводорода. Получают взаимодействием магния с серой или сероводородом.
Сульфат магния MgSO 4 . Бесцветные ромбоэдрические диамагнитные кристаллы. Растворяется в воде, спирте и эфире. Можно получить в лаборатории взаимодействием оксида или карбоната магния с серной кислотой. В промышленности получают из морской воды или из природных минералов - карналлита и кизерита.
Применяется для отделки тканей, производства огнестойких тканей и бумаги, при дублении кожи, в качестве протравы в красильной промышленности.
Нитрат магния Mg(NO 3 ) 2 . Бесцветные кристаллы. Растворяется в воде, спирте и концентрированной азотной кислоте. В промышленности получают из природного минерала нитромагнезита. Получают в лаборатории взаимодействием магния, оксида магния или гидроксида магния с разбавленной азотной кислотой.