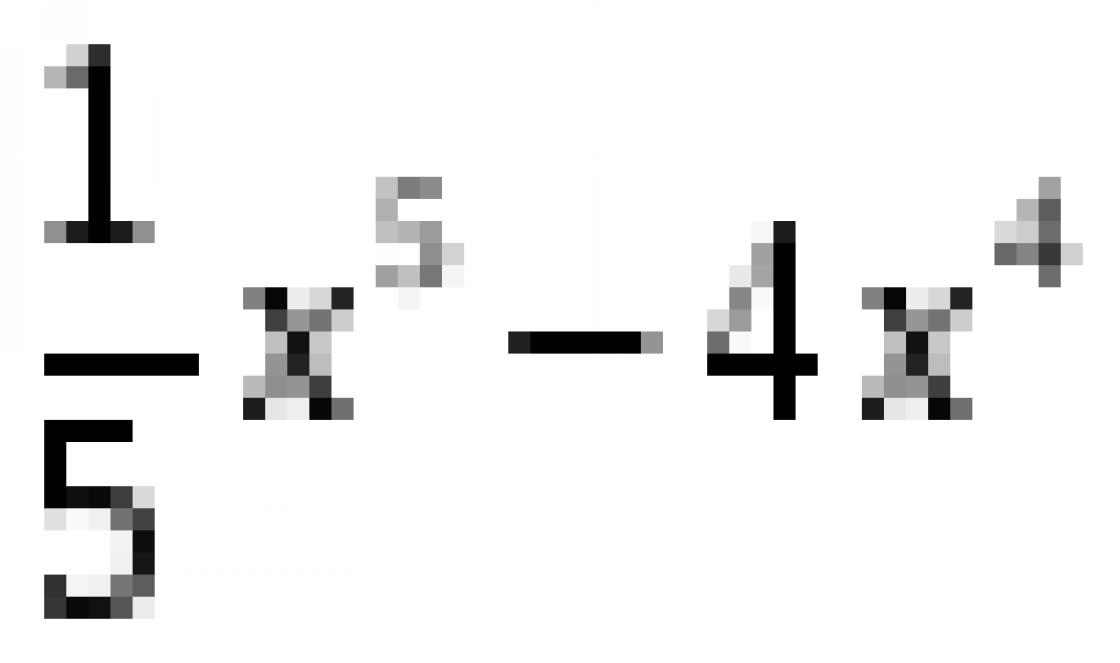At Огромное ледяное озеро на Марсе и план Маска
План по колонизации Марса всегда предполагал наличие относительно лёгкого доступа к воде. Найденное огромное озеро (14,300 кубических километров льда) — карта на картинке — идеально хорошо ложится в План.
Вспомним план Маска — цитирую дословно, а потом перевод, комментарии и детализация из других выступлений Илона.
1.
Send Dragon scouting missions, initially just to make sure we know how to land without adding a crater and then to figure out the best way to get water for the CH4/O2 Sabatier Reaction.
2.
Heart of Gold spaceship flies to Mars loaded only with equipment to build the propellant plant.
3.
First crewed mission with equipment to build rudimentary base and complete the propellant plant.
4.
Try to double the number of flights with each Earth-Mars orbital rendezvous, which is every 26 months, until the city can grow by itself.
Его текст — италик , мои комментарии — прямым.
1. Послать Дракона на разведку. Вначале, чтобы удостовериться, что мы знаем как посадить корабль без того, чтобы добавить ещё один кратер, и затем найти лучший способ добычи воды для CH4/O2 реакции Сабатье.
Не добавить кратер
Илон шутит, добавить кратер — имеется ввиду разбить посадочный модуль. Его выступление происходило сразу после того, как миссия Экзо Марс добавила хороший кратер к поверхности планеты. Дракон — миссия Красный Дракон, которая должна стартовать в 2018. Имеется ввиду отработка и демонстрация вертикальной посадки на двигателях, аналогичной посадке на космодром и плавучую платформу "Конечно, я всё ещё люблю тебя".
Миссия Красный Дракон
Дракон будет нагружен роботами для разведывательных работ и добычи полезных ископаемых. По-видимому, SpaceX будет заказывать роботов другим организациям. Но это решение пока не озвучено. У Маска есть и собственная компания, занятая роботами, в которую уже вложен по крайней мере миллиард долларов.
Вода и реакция Сабатье
Две химические реакции и, соответсвенно, две установки для химических реакций будут главными на начальном этапе колонизации: а. Реакция электролиза воды, б. Реакция Сабатье
а. 2Н2О = 2Н2 + О2 — В этой реакции разложение воды образует кислород и водород
б. CO2 + 4H2 → CH4 + 2H2O + энергия — Реагируя с углекислым газом марсианской атмосферы, водород даёт выход метана и воды. Реакция Сабатье идёт с выделением энергии, которая может/должна быть утилизирована.
Метан и кислород — являются топливом и окислителем для кораблей серии ITS (Межпланетные Транспортные Корабли), первый из которых получит культовое имя "Золотое Сердце".
Интересно, что установка для реакции Сабатье уже построена и испытана при концентрациях CO2, соответствующих марсианской атмосфере. Но это будет развиваться и совершенствоваться.
2. "Золотое Сердце" полетит к Марсу, нагруженное только оборудованием, необходимым для строительства завода по производству топлива.
"Золотое Сердце" полетит в беспилотном режиме и забросит на поверхность Марса до 100 тонн оборудования и материалов. В основном это будет оборудование необходимое для осуществления в промышленных масштабах добычи воды и производства этих 2 реакций: электролиза воды и Сабатье. Очевидно, что источники энергии входят в это оборудование.
3. Задача первой пилотируемой миссии — строительство рудиментарной базы и завершение предприятия по производству топлива.
В первой пилотируемой миссии будет 12 человек. У Илона есть много конкретных идей из чего должна состоять "рудиментарная база" — её имя Mars Base Alpha — но сейчас не время обсуждать все детали. Предполагается активное использование естественных тоннелей и пещер, которые уже нашло НАСА, и строительство других подземных помещений. На поверхности предполагаются прозрачные шатры из стекла и с арматурой из углепластиков.
Очевидно, что основной работой будет завершение налаживания предприятий, оборудование для которых доставит "Золотое Сердце": добыча воды, энергия, реакция электролиза, реакция Сабатье.
4. После этого задача будет удваивать число посылаемых кораблей на каждом сближении Земли и Марса, которые происходят каждые 26 месяцев, пока город не начнёт расти независимо.
Тут нечего комментировать. Нерешённых проблем сотни. Хотя трудными представляются только две: правила взаимодействия с родной биосферой Марса (которая наверняка есть и наверняка очень хрупкая) и будут ли бэби нормально вынашиваться и рождаться при 1/3 земной тяжести.
Ледяное озеро находится в удобном районе Марса, средние широты, есть много очень ровных мест подходящих для посадки. Слой грунта, покрывающего лёд, толщиной от одного метра до десяти. Лёд частично перемешен тоже с песком, но чистота льда в пределах 50-85%. Глубина ледяного озера от 100 до 200 метров.
Запас воды сравнимый с одним из американских Великих Озёр — "Верхним".
При продолжительных полетах (несколько месяцев) в герметической кабине автономного типа выгодным представляется физико-химический способ регенерации газовой среды в кабине, использующий для получения кислорода продукты обмена веществ человека. В углекислом газе и парах воды, выделяемых человеком в сутки, содержится приблизительно 2,8 кг кислорода, что существенно превышает суточную норму потребления кислорода одним человеком. Таким образом, имеется принципиальная возможность получать 02 из продуктов жизнедеятельности человека. Из углекислого газа, выделяемого в сутки одним человеком (~0,9 кг), можно получить 0,65 кг кислорода, а для получения недостающих 0,15-0,25 кг кислорода потребуется лишь 0,17-0,28 кг воды, в качестве которой можно использовать «излишнюю» метаболическую воду„ выделяющуюся организмом в процессе обмена веществ.
Система физико-химической регенерации может быть основана на использовании реакции Сабатье . Таким образом, конечным продуктом для получения кислорода служит вода, поступающая в электролизер, который является одним из основных узлов системы физико-химической регенерации газовой среды в кабине. В подобной системе регенерации для сорбции С02 могут быть использованы цеолиты, а для удаления из кабины избытка влаги-холодильно-сушиль- ные агрегаты (ХСА) (4.2), обеспечивающие конденсацию паров воды.
Если осуществляются все этапы восстановления кислорода, то необходимое для реакции Сабатье количество водорода обеспечивается электролизом воды и пиролизом метана, который требует значительных энергозатрат.
Структурная схема физико-химической системы регенерации. Система работает следующим образом. Воздух из кабины посредством вентиляторов В циркулирует по двум контурам: через цеолиты Ц и ХСА, в которых происходит сорбция СОг и конденсация влаги. Цеолитовые поглотители соединены в два параллельных блока и работают попеременно-один в режиме сорбции, другой в режиме десорбции. Поглощенная цеолитами углекислота подается через конденсатор С02 в метановый реактор, куда также подается через концентратор водород из катодного пространства электролизера. В метановом реакторе при соответствующих условиях происходит разложение С02 по реакции Сабатье до воды и метана. Вода из реактора подается в электролизер, а метан выводится из контура. Некоторая часть воды поступает в электролизер и от поглотителей Н20, стоящих перед цеолито- выми патронами.
Следовательно, выбирается электролит, имеющий наименьшее значение р0. Это достигается выбором электролита и его ©полне определенной концентрации (для КОН - 30-33°/о). Величина перенапряжения г\ складывается из величин э.д.с. .концентрационной и химической поляризации. Как видно из уравнений (4.8) и (4.9), в процессе электролиза концентрация гидроксильных ионов в катодном пространстве увеличивается, в анодном-уменьшается. Это приводит к возникновению концентрационной э.д.с., направленной против э.д.с. внешнего -источника тока. Возникновение э.д.с. химической поляризации, направленной также против э.д.с. внешнего источника тока, связано с замедленностью разряда ионов на электродах я наличием стадии образования молекулярного 02 и Н2 из.атомарного. Практически величина зависит от следующих факторов: материала электродов, температуры, плотности тока, природы и концентрации электролита. Как показывает опыт, из металлов, устойчивых в щелочах, наиболее низким значением характеризуются металлы группы железа, которые и применяются на практике. Повышение температуры электролита приводит к снижению перенапряжения. Однако при Этом значительно возрастает унос паров электролита выделяющимися газами. На практике обычно проводят электролиз при температурах, не превышающих 80°С. Значительное, влияние на величину т] оказывает плотность тока. Перенапряжение уменьшается с уменьшением плотности тока. Поэтому выгодно работать с электродами, имеющими возможно большую поверхность.
Указанное количество кислорода близко к средней суточной норме потребления его человеком. Отсюда следует, что для обеспечения кислородом одного человека необходимо пропускать ток через электролизную установку порядка 120 А. Средняя допустимая плотность тока лежит в пределах 0,1-0,15 А/см2. Поэтому общая поверхность электродов электролизера будет лежать в пределах 800-1200 см2, а с учетом увеличения потребления 62 при большой физической нагрузке общая поверхность электродов должна быть увеличена в 2-3 раза.
Выделяющиеся при этом на активной поверхности электродов молекулы водорода и кислорода проходят через крупные поры электродов к их внешней поверхности и выдавливаются в соответствующие газовые камеры. В электродах образуется подвижная граница «газ-электролит», положение которой определяется соотношением диаметров пор в элементах ячейки и наличием противодавления в газовых камерах. При повышении давления в последних эта граница перемещается внутрь, так как электролит выдавливается из крупных пор электродов, оставаясь лишь в мелких. При этом пары электролита, увлекаемые газами, будут оседать на стенках освободившихся крупных пор и возвращаться в диафрагму благодаря ее вса-
Возможная схема электролизной установки представлена на 4.5. Полученные в электролизере Эл кислород и водород поступают в уравнитель давлений УД. При повышении давления в одной из магистралей упругая мембрана прогибается, уменьшая отвод, другого газа и выравнивая тем самым давление в газовых камерах. В холодильнике-разделителе ХР отделяются пары эдектролита, конденсируясь на стенках теплообменника, омьщаемых хладагентом." Фильтр Ф и колонка дожигания КД (нагретые катализаторы) окончательно очищают кислород, который приобретает нужную температуру в теплообменнике ТО. Далее кислород поступает в систему кислородного питания экипажа.
Водород от электролизера поступает в метановый реактор. Перспективной физико-химической системой является система, основанная на электролизе солей (карбонаты калия, например). Здесь в самой электролизной ячейке происходит поглощение С02 из воздуха кабины и выделение из него в результате промежуточных реакций газообразного кислорода.
Вообще, если честно, нобелевских лауреатов Полей Сабатье могло быть двое (удивительный случай), и они не родственники. Историк Поль Сабатье был пять раз номинирован на премию по литературе за биографию св. Франциска Ассизского, но увы… А химик премию получил, в полном соответствии с завещанием Нобеля, как принесший максимальную пользу обществу. Но обо всем по порядку.
Поль Сабатье
Нобелевская премия по химии 1912 года (разделил премию с Виктором Гриньяром). Формулировка Нобелевского комитета: «За предложенный им метод гидрогенизации органических соединений в присутствии мелкодисперсных металлов, который резко стимулировал развитие органической химии».
Будущий химик и нобелиат Поль Сабатье родился в небольшом французском городке Каркасон. Его папа был мелким землевладельцем, но лишился собственности за неуплату налогов и открыл шляпный магазин. Поль был младшим из семи детей и всегда отличался прилежанием и хорошими успехами в школе. Когда мальчик готовился к поступлению в лицей в Тулузе, он впервые попал на публичные лекции по физике и химии (да, тогда тоже уже были местные просветители). Эти лекции и побудили его к занятиям большой наукой. А для этого, полагал Сабатье, нужно быть самым лучшим.
Когда пришла пора поступать в высшую школу, Поль поступал одновременно в знаменитые Эколь Политекник и Эколь Нормаль. Пришлось выбирать, и в итоге молодой человек в 1877 году лучшим в группе окончил Высшую нормальную школу в Париже - один из самых престижных французских вузов.
Потом Поль еще год изучал физику в Ницце, а затем начал заниматься химией у великого Марселена Бертло в знаменитом Коллеж де Франс - учебно-научном заведении, основанном еще в первой половине XVI века. Сабатье стал ассистентом выдающегося химика. Кстати, любопытно, что сейчас площадь в Париже, на которой стоит это заведение, носит имя Бертло.
Коллеж де Франс
Wikimedia Commons
Учитель Сабатье стоял у истоков современного органического синтеза (а попутно и биохимии), многие из известных еще по школьному курсу веществ синтезировал именно он: бензол, этилен, этиловый спирт. Именно Бертло синтезировал аналоги природных жиров и показал, что они эфиры глицерина (а последний - трехатомный спирт, что показал тоже Бертло). Наконец, он синтезировал и аналоги жирных кислот.
Марселен Бертло
Wikimedia Commons
Правда, Сабатье сначала пришлось заняться неорганикой. Как он потом вспоминал с усмешкой, «я больше всего занимаюсь тем предметом, который мне меньше всего нравится». Первой исследовательской работой будущего нобелевского лауреата стала термохимия серы и сульфидов металлов. В 26 лет с этой работой он стал доктором химии. Сабатье сразу же стал очень авторитетным химиком. В 1884 году, как только ему исполнилось 30, минимальный возраст для занятия профессорской должности, наш герой получил кафедру общей химии в Университете Тулузы. В этом университете он оставался профессором до выхода в отставку через 45 лет.
Примечательный факт: через 23 года после назначения Сабатье получил сразу два лестных предложения, связанных с двумя тяжелыми утратами, которые понесла французская и мировая химия: с интервалом всего в месяц, 20 февраля и 18 марта 1907 года, умерли еще сравнительно молодой Анри Муассан и почтенный учитель Сабатье, Марселен Бертло. Тулузскому профессору предложили на выбор кафедру Муассана в Сорбонне и кафедру Бертло в Коллеж де Франс. Тот остался в провинции.
В Тулузе Сабатье занялся органикой. Как раз с опытами Муассана и оказался связан главный успех химика.
Анри Муассан
Wikimedia Commons
Началось все с неорганики. Людвиг Монд с соавторами получил комплексы металлов с группой СO – «карбонилметаллы». Сабатье получил такие же, но с молекулами NO, «нитрозометаллы», и, взяв в помощники студента (и священника) Жана-Баптиста Сендерана, начал пытаться получить комплексы металлов с ненасыщенными углеводородами: этиленом и ацетиленом. Упомянутый выше Муассан вместе с коллегой Шарлем Моро пытался присоединить ацетилен к свежевосстановленным из оксидов металлам: никелю, кобальту и железу. Но ничего не получалось, зато вроде бы выделялись водород и жидкость, которая казалась авторам смесью ароматических углеводородов. Но реакция была капризной, и Муассан оставил свои попытки.
В 1897 году Сабатье попросил у Муассана разрешение повторить его опыты, но взял вместо ацетилена менее активный этилен. С никелем и при 300 градусах реакция пошла, но получался этан, а не водород, как предполагал Муассан. Значит, сначала при 300 градусах частично разлагается этилен с выделением водорода, а потом водород в присутствии никеля присоединяется к этилену, образуя этан! Тогда Сабатье с Сандераном взяли смесь этилена и водорода, и такая реакция пошла уже при 30-35 градусах!
Реакция Сабатье - Сандерана
Wikimedia Commons
Так химики получили простой и дешевый метод гидрирования двойной и тройной связи, который сейчас известен под именем реакции Сабатье - Сандерана. А главное, этот метод получила промышленность. Почему реакция гидрогенизации имеет очень важное значение именно для промышленности, особенно для пищевой?
Вот вам пример: масло. Обычное сливочное масло. Вкусно и хорошо, но для хлебопекарной и кондитерской промышленности иногда слишком дорого. Было бы неплохо получить заменитель из растительных масел. Но они жидкие, в том числе потому, что жирах растительного происхождения присутствуют остатки ненасыщенных кислот. То есть наличествует двойная связь. Значит, можно попробовать присоединить к ней водород, гидрогенизировать. Действительно, если гидрогенизировать растительное масло, то получится знакомый всем нам маргарин. Но использовавшиеся тогда в качестве катализатора платина и палладий делали такое производство совершенно неактуальным.
Несмотря на то, что Сабатье не особо стремился к деньгам и славе (он совершил множество открытий в катализе, но получил лишь пару патентов, предпочитая заниматься наукой и преподаванием), признание пришло весьма быстро: уже в 1912 году Сабатье стал нобелевским лауреатом по химии, разделив премию с Виктором Гриньяром, открывшим эпоху металлоорганической химии и тоже давшим химикам выдающийся метод синтеза новых соединений.
Потом будет еще почти 30 лет жизни. Сабатье откроет процесс, получивший его имя, реакцию получения метана (CO 2 + 4H 2 → CH 4 + 2H 2 O), создаст теорию катализа, в которой будет спорить со Сванте Аррениусом , доказывая, что реакция происходит на поверхности катализатора...
А в Нобелевской лекции он скажет: «В течение последних 15 лет мысль о механизме катализа никогда не оставляла меня. Все мои успехи - это результат рожденных ею заключений. Теории не могут претендовать на бессмертие. Это всего лишь плуг, которым пахарь пользуется для того, чтобы провести борозду, и который он имеет полное право после жатвы заменить другим, более совершенным».
ИПолучение
1. Реакция
Вюрца
: действие металлического натрия на
моногалогенопроизводные углеводородов. Происходит удвоение углеродного скелета. Реакция подходит для получения симметричных алканов.
2CH 3 –CH 2 Br + 2Na = CH 3 –CH 2 –CH 2 –CH 3 +2NaBr
2. Реакция Дюма
: декарбоксилирование солей карбоновых кислот - сплавление со щелочами.
CH 3 COONa (тв.) + NaOH(тв.) = CH 4 + Na 2 CO 3
3. Реакция Кольбе
: электролиз растворов солей карбоновых кислот:
CH 3 COONa + 2H 2 O =[эл.ток]= 2СО 2 + Н 2 + С 2 Н 6 + 2NaOH
4. Синтез Густавсона
: отщепление двух атомов галогена от дигалогеналканов:
СlCH2-CH2-CH2-CH2Cl + Zn = C 4 H 8 (циклобутан) + ZnCl 2
Вместо магния может использоваться цинк.
5. Синтез Лебедева
: получение бутадиена из этанола.
2C2H5OH = Н 2 + 2Н 2 O + CH2=CH-CH=CH2
Химические свойства
1. Реакция Коновалова
– нитрование алканов разбавленной (10%-ной) азотной кислотой:
C 2 H 6 + HNO 3 = C 2 H 5 NO 2 + Н 2 O
Избирательность нитрования:
третичный атом вторичный атом первичный атом углерода.
2. Эффект
Хараша:
присоединение бромоводорода в присутствии перекиси. Реакция протекает против правила Марковникова:
СН 3 -СН=СН 2 + HBr =[Н 2 О 2 ]= СН 3 -СН 2 -СН 2 Br
3. Реакция Вагнера
: реакция с холодным водным раствором перманганата калия – мягкое окисление алкенов (образуется диол)
3СН 3 -СН=СН 2 + 2KMnO 4 + 4H 2 O = 2MnO 2 + 2KOH + 3СН 3 -СН(OH)-СН 2 (OH)
4. Реакция Кучерова
: гидратация алкинов. Присоединение воды происходит в присутствии солей ртути (II) и идет через образование неустойчивого енола, который изомеризуется в альдегид или кетон. Гидратация ацетилена дает альдегид, других алкинов – кетон.
C 2 H 2 + H 2 O = CH 3 CHO
5. Реакция Зелинского
: тримеризация ацетилена над активированным углем. Образуется бензол.
3C 2 H 2 = C 6 H 6
6. Реакция Зинина
: восстановление нитросоединений в растворе в щелочной и нейтральной среде:
R-NO 2 + 3(NH 4) 2 S = R-NH 2 + 3S + 6NH 3 +2H 2 O
ТО, ЧТО НАС ОБЬЕДИНЯЕТ...
Реакция Арбузова (перегруппировка Арбузова, изомеризация Арбузова) Каталитическая изомеризация эфиров фосфористой кислоты в эфиры алкилфосфиновых кислот (1904).
Правило Бейльштейна Если оба заместителя в ароматическом кольце принадлежат к одному и тому же типу, то преобладающее направление замещения определяется тем из них, влияние которого сильнее (1866).
Проба Бейльштейна Открытие галогенов в органических соединениях путем прокаливания на окисленной медной проволоке (1872 ). Вещество в смеси с CuO наносят на медную (или платиновую) проволоку и вносят в пламя; образующиеся при этом летучие галогениды меди окрашивают пламя в зеленый или голубовато-зеленый цвет.
Реактив Бенедикта (проба Бенедикта ) . Обнаружение алифатических альдегидов действием на них водного раствора, содержащего сульфат меди(II) CuSO 4 , карбонат натрия Na 2 CO 3 и цитрат натрия. При нагревании образуются красные, желтые, зеленые осадки.
Реакция Бородина Разложение карбамида:
Реакция Бутлерова-Лермонтовой-Эльтекова Получение углеводородов изостроения каталитическим алкилированием низших олефинов алкилгалогенидами (1878).
Реакция Вагнера (окисление по Вагнеру, перманганатная проба). Окисление органических соединений, содержащих двойную связь, действием 1-3%-го раствора перманганата калия (1887 ) в цис -a-гликоли в щелочной среде (считается положительной, если раствор перманганата быстро обесцвечивается в кислой среде или буреет в щелочной и нейтральной):
Реакция Вёлера Взаимодействие карбида кальция с водой (1862). Практическое значение реакция приобрела после того, как А.Муассан и Т.Вильсон разработали способ дешевого получения карбида кальция в электропечи в результате сплавления кокса и извести (1892).
Реакция Вильямсона (метод Вильямсона)
. Получение простых эфиров из алкилгалогенида и алкоголята натрия (или калия): 
Реакция Вюрца
. . Синтез алканов действием металлического натрия в инертном растворителе на алкилгалогениды (1855):
в общем виде:
Реакция Вюрца-Фиттига. . Получение алкилбензолов из смеси алифатических и ароматических галогенидов действием металлического натрия в инертном растворителе (1864):
Реакция Гарриеса. (1866-1923), профессор (Германия). Основные исследования посвящены химии каучука. Президент Немецкого химического общества (1920-1922). Образование озонидов.
Реакция Гаттермана.
Получение ароматического альдегида при взаимодействии фенола с хлороводородом и циановодородом в присутствии катализаторов (кислот Льюиса) с последующим гидролизом продукта (1898):
Правила ориентации Голлемана
Ориентанты (заместители) первого рода (CH 3 , C 2 H 5 , галогены, аминогруппа, гидроксил) повышают реакционную способность ароматического ядра и направляют реагенты в орто- и параположения.
2. Ориентанты (заместители) второго рода (нитро- и сульфогруппы, карбоксильная и карбонильная группы) уменьшают реакционную способность ароматического ядра и направляют реагенты в метаположение (1895). (В настоящее время эти эффекты объясняются на основе электронных представлений: мезомерные и индукционные эффекты, 1920 г.).
Реакция Гофмана
. Получение алифатических аминов из алкилгалогенидов: 
и так далее до образования третичного амина (CH 3) 3 N.
Реактив Гриньяра
. Синтез органических веществ из алкилгалогенидов и магния в эфире. Реакция открыта П.Барбье в 1899 г. и подробно изучена В.Гриньяром в 1900 г.:
Реактив Гриньяра RMgX используется для присоединения по кратным связям 
Реакция Густавсона
. Получение циклоалканов из дигалогенпроизводных (1887
). 
Реакция Дильса-Альдера (диеновый синтез ) Присоединение ненасыщенного соединения, кратная связь которого активирована соседней группой (такое соединение имеет название "диенофил ": акролеин, малоновый ангидрид, кротоновый альдегид), к ненасыщенному углеводороду (диену ), имеющему сопряженные двойные связи (бутадиен, циклогексадиен, антрацен, фуран) (1928).
Правило Зайцева
. Отщепление галогеноводородных кислот от алкилгалогенидов или воды от спиртов преимущественно происходит так, что с галогеном или гидроксилом уходит водород от наименее гидрогенизованного соседнего атома углерода (1875
): 
Реакция Зелинского-Казанского (метод Зелинского-Казанского)
. Тримеризация ацетилена (полимеризация ацетилена) на активированном угле при нагревании (1924)
: 
Реакция Зелинского (необратимый катализ, катализ Зелинского)
Каталитическое диспропорционирование циклогексадиена и циклогексена (1911): 
Реакция Зинина
. Восстановление ароматических нитросоединений (1842
): ![]()
Реакция Канниццаро
. Окислительно-восстановительное диспропорционирование двух молекул ароматического альдегида в щелочной среде, приводящее к образованию спирта и кислоты (1853): 
Реакция Кирхгофа . Получение глюкозы гидролизом крахмала при его нагревании с катализатором - разбавленной серной кислотой (1811 ):
Реакция Клемменсена (восстановление по Клемменсену)
. Восстановление альдегидов и кетонов в гомологи бензола водородом в момент его выделения (восстановление карбонильной группы до метиленовой) (1913):
Реакция Кольбе-Шмитта
. Получение ароматических оксикислот карбоксилированием фенолятов щелочных металлов (1860): 
Реакция Кольбе (электрохимическая) . Получение алканов с четным числом атомов углерода электролизом растворов солей щелочных металлов и карбоновых кислот с неразветвленной углеродной цепью (1849):
Реакция Коновалова . Получение нитроалканов (1888 ):
Реакция Кучерова (гидратация по Кучерову)
. Каталитическая гидратация ацетиленовых углеводородов с образованием карбонилсодержащих соединений (1881
):
Реакция Лебедева . Получение бутадиена пиролизом этанола (1926 ):
Реакция Львова-Шешукова . Хлорирование олефинов в a-положение к двойной связи, сопровождающееся аллильным сдвигом двойной связи (1883):
Правило Марковникова . В случае присоединения водородсодержащих соединений (протонных кислот или воды) к несимметричному алкену атом водорода преимущественно присоединяется к наиболее гидрогенизованному атому углерода, стоящему при двойной связи (1869 ):
Реакция Настюкова (формалитовая реакция)
. Взаимодействие ароматических углеводородов с формальдегидом (определение ароматических углеводородов) в присутствии концентрированной серной кислоты (1904):
Образование красно-коричневой смолы подтверждает наличие бензола и его гомологов. Реакции мешает присутствие непредельных циклических соединений.
Правило Несмеянова-Борисова . Электрофильные и радикальные замещения у углеродного атома, связанного двойной углерод-углеродной связью, происходят с сохранением геометрической конфигурации молекулы вещества.
Реакция Раймера-Тимана . Получение ароматических о -оксиальдегидов взаимодействием фенола с хлороформом в растворе щелочи. Реакция приводит к введению альдегидной группы в бензольное кольцо (замещение обычно происходит в ортоположение):
Реакция Розенмунда
. Получение ароматических альдегидов из хлорангидридов кислот в среде бензола, толуола и других ароматических углеводородов:
Реакция открыта М.М.Зайцевым в 1872 г. и подробно изучена К.В.Розенмундом в 1918 г.
Реакция Сабатье-Сандерана . Жидкофазное гидрирование этилена до этана в присутствии мелкораздробленного никеля как катализатора (1899):
Реакция Савича . Получение алкинов из дигалогенпроизводных алканов (1861):
Проба Селиванова
. Качественное открытие фруктозы (1887
) (кетозы при нагревании с резорцином и соляной кислотой дают вишнево-красное окрашивание; альдозы в этих же условиях взаимодействуют медленнее и дают бледно-розовую окраску):
(Можно использовать раствор, состоящий из 0,05 г резорцина в 50 мл воды и нескольких капель концентрированной соляной кислоты плотностью 1,19 г/мл.)
Реакция Тищенко . Диспропорционирование альдегида - получение сложного эфира из альдегида - в присутствии алкоголята алюминия (1906):
Проба Толленса (реакция "серебряного зеркала") . Взаимодействие формальдегида с аммиачным раствором оксида серебра (реактив Толленса):
Реакция Ульмана . Получение высших ароматических гомологов из арилгалогенидов действием порошкообразной меди:
Реакция Фаворского . Конденсация карбонильных соединений с алкинами с образованием ацетиленовых спиртов:
Синтез Фишера-Тропша . Получение алканов при каталитическом гидрировании (взаимодействие с водородом) монооксида углерода под давлением (1923).
Реакция Фокина
. Гидрогенизация жиров (1902):
Реакция Фриделя-Крафтса . Алкилирование или ацилирование ароматических соединений соответственно алкил- или ацилгалогенидами (получение гомологов бензола) в присутствии безводного катализатора (AlCl 3 , BF 3 , ZnCl 2 и др.) (1877):
Реакция Чугаева (ксантогеновая реакция) . Превращение спиртов в алкены термическим разложением ксантогеновых эфиров, получаемых из этих спиртов (1902).
Крекинг по Шухову . Высокотемпературная переработка нефтяного сырья для получения продуктов меньшей молекулярной массы - расщепление углеводородов нефти (1891).
Правило Эльтекова (перегруппировка Эльтекова) . Соединения, в которых гидроксильная группа находится при углеродном атоме, образующем углерод-углеродную кратную связь (енолы), неустойчивы и изомеризуются в соответствующие карбонильные соединения - альдегиды или кетоны (1877):
Реакция Юрьева . Взаимные превращения 5-членных гетероциклических соединений, содержащих один гетероатом (1936).
В качестве более эффективного катализатора может применяться рутений с оксидом алюминия . Процесс описывается следующей реакцией:
CO 2 + 4H 2 → CH 4 + 2H 2 O + энергия ∆H = −165.0 кДж/моль (для запуска реакции требуется некоторое начальное количество энергии/тепла)
Жизнеобеспечение космической станции
В настоящее время генераторы кислорода на борту Международной космической станции производят кислород из воды посредством электролиза и сбрасывают образующийся водород в космическое пространство. Во время дыхания кислородом образуется диоксид углерода, который необходимо удалять из воздуха и впоследствии избавляться от него. Этот подход требует регулярных поставок значительного количества воды на космическую станцию для производства кислорода, помимо воды для питья, гигиены и т. д. Такое значительное снабжение водой станет недоступно в будущих долговременных полётах за пределы околоземной орбиты.
Третьим и, возможно, более элегантным решением стехиометрической проблемы, было бы совмещение реакции Сабатье и реакции водорода с диоксидом углерода в едином реакторе следующим образом:
3CO 2 + 6H 2 → CH 4 + 2CO + 4H 2 O
Эта реакция слабо экзотермическая и при электролизе воды позволяет достичь соотношения 4:1 между кислородом и метаном, обеспечивая большой резервный запас кислорода. По схеме, когда с Земли доставляется лишь лёгкий водород, а тяжёлые кислород и углерод вырабатываются на месте, обеспечивается выигрыш в массе 18:1. Такое использование местных ресурсов привело бы к значительной экономии веса и стоимости в любых пилотируемых полётах на Марс (или автоматических полётах с доставкой грунта).
Напишите отзыв о статье "Реакция Сабатье"
Отрывок, характеризующий Реакция Сабатье
– Но если по каким либо причинам вам неприятен разговор со мною, – сказал старик, – то вы так и скажите, государь мой. – И он вдруг улыбнулся неожиданно, отечески нежной улыбкой.– Ах нет, совсем нет, напротив, я очень рад познакомиться с вами, – сказал Пьер, и, взглянув еще раз на руки нового знакомца, ближе рассмотрел перстень. Он увидал на нем Адамову голову, знак масонства.
– Позвольте мне спросить, – сказал он. – Вы масон?
– Да, я принадлежу к братству свободных каменьщиков, сказал проезжий, все глубже и глубже вглядываясь в глаза Пьеру. – И от себя и от их имени протягиваю вам братскую руку.
– Я боюсь, – сказал Пьер, улыбаясь и колеблясь между доверием, внушаемым ему личностью масона, и привычкой насмешки над верованиями масонов, – я боюсь, что я очень далек от пониманья, как это сказать, я боюсь, что мой образ мыслей насчет всего мироздания так противоположен вашему, что мы не поймем друг друга.
– Мне известен ваш образ мыслей, – сказал масон, – и тот ваш образ мыслей, о котором вы говорите, и который вам кажется произведением вашего мысленного труда, есть образ мыслей большинства людей, есть однообразный плод гордости, лени и невежества. Извините меня, государь мой, ежели бы я не знал его, я бы не заговорил с вами. Ваш образ мыслей есть печальное заблуждение.
– Точно так же, как я могу предполагать, что и вы находитесь в заблуждении, – сказал Пьер, слабо улыбаясь.
– Я никогда не посмею сказать, что я знаю истину, – сказал масон, всё более и более поражая Пьера своею определенностью и твердостью речи. – Никто один не может достигнуть до истины; только камень за камнем, с участием всех, миллионами поколений, от праотца Адама и до нашего времени, воздвигается тот храм, который должен быть достойным жилищем Великого Бога, – сказал масон и закрыл глаза.
– Я должен вам сказать, я не верю, не… верю в Бога, – с сожалением и усилием сказал Пьер, чувствуя необходимость высказать всю правду.
Масон внимательно посмотрел на Пьера и улыбнулся, как улыбнулся бы богач, державший в руках миллионы, бедняку, который бы сказал ему, что нет у него, у бедняка, пяти рублей, могущих сделать его счастие.
– Да, вы не знаете Его, государь мой, – сказал масон. – Вы не можете знать Его. Вы не знаете Его, оттого вы и несчастны.
– Да, да, я несчастен, подтвердил Пьер; – но что ж мне делать?
– Вы не знаете Его, государь мой, и оттого вы очень несчастны. Вы не знаете Его, а Он здесь, Он во мне. Он в моих словах, Он в тебе, и даже в тех кощунствующих речах, которые ты произнес сейчас! – строгим дрожащим голосом сказал масон.
Он помолчал и вздохнул, видимо стараясь успокоиться.
– Ежели бы Его не было, – сказал он тихо, – мы бы с вами не говорили о Нем, государь мой. О чем, о ком мы говорили? Кого ты отрицал? – вдруг сказал он с восторженной строгостью и властью в голосе. – Кто Его выдумал, ежели Его нет? Почему явилось в тебе предположение, что есть такое непонятное существо? Почему ты и весь мир предположили существование такого непостижимого существа, существа всемогущего, вечного и бесконечного во всех своих свойствах?… – Он остановился и долго молчал.
Пьер не мог и не хотел прерывать этого молчания.
– Он есть, но понять Его трудно, – заговорил опять масон, глядя не на лицо Пьера, а перед собою, своими старческими руками, которые от внутреннего волнения не могли оставаться спокойными, перебирая листы книги. – Ежели бы это был человек, в существовании которого ты бы сомневался, я бы привел к тебе этого человека, взял бы его за руку и показал тебе. Но как я, ничтожный смертный, покажу всё всемогущество, всю вечность, всю благость Его тому, кто слеп, или тому, кто закрывает глаза, чтобы не видать, не понимать Его, и не увидать, и не понять всю свою мерзость и порочность? – Он помолчал. – Кто ты? Что ты? Ты мечтаешь о себе, что ты мудрец, потому что ты мог произнести эти кощунственные слова, – сказал он с мрачной и презрительной усмешкой, – а ты глупее и безумнее малого ребенка, который бы, играя частями искусно сделанных часов, осмелился бы говорить, что, потому что он не понимает назначения этих часов, он и не верит в мастера, который их сделал. Познать Его трудно… Мы веками, от праотца Адама и до наших дней, работаем для этого познания и на бесконечность далеки от достижения нашей цели; но в непонимании Его мы видим только нашу слабость и Его величие… – Пьер, с замиранием сердца, блестящими глазами глядя в лицо масона, слушал его, не перебивал, не спрашивал его, а всей душой верил тому, что говорил ему этот чужой человек. Верил ли он тем разумным доводам, которые были в речи масона, или верил, как верят дети интонациям, убежденности и сердечности, которые были в речи масона, дрожанию голоса, которое иногда почти прерывало масона, или этим блестящим, старческим глазам, состарившимся на том же убеждении, или тому спокойствию, твердости и знанию своего назначения, которые светились из всего существа масона, и которые особенно сильно поражали его в сравнении с своей опущенностью и безнадежностью; – но он всей душой желал верить, и верил, и испытывал радостное чувство успокоения, обновления и возвращения к жизни.
– Он не постигается умом, а постигается жизнью, – сказал масон.
– Я не понимаю, – сказал Пьер, со страхом чувствуя поднимающееся в себе сомнение. Он боялся неясности и слабости доводов своего собеседника, он боялся не верить ему. – Я не понимаю, – сказал он, – каким образом ум человеческий не может постигнуть того знания, о котором вы говорите.