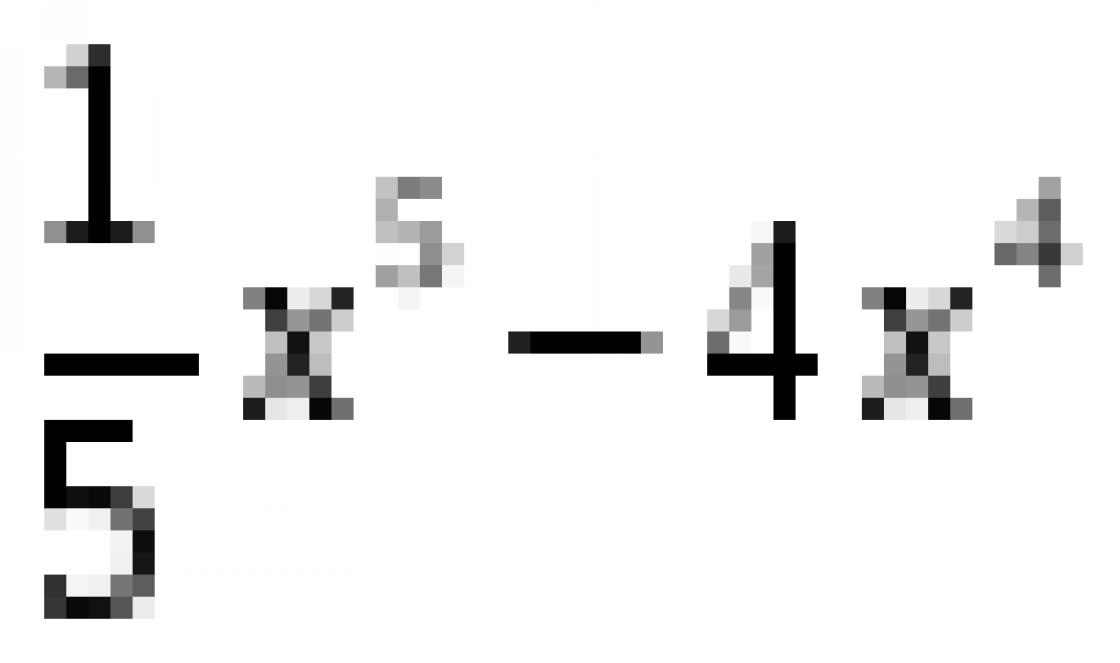Состояние химического равновесия зависит от целого ряда факторов: температуры, давления, концентрации реагирующих веществ. Рассмотрим подробнее влияние этих факторов.
Изменение концентрации компонентов равновесной системы при постоянной температуре смещает равновесие, однако, значение константы равновесия при этом не меняется. Если для реакции увеличить концентрацию вещества А (или В), то скорость прямой реакции, увеличится, а скорость обратной реакции в начальный момент времени не изменится. Равновесие нарушится. Затем концентрация исходных веществ начнет уменьшаться, а концентрация продуктов реакции - увеличиваться, и это будет происходить до тех пор, пока не установится новое равновесие. В таких случаях говорят, что равновесие смещается в сторону образования продуктов реакции или смещается вправо.
Рассуждая таким же образом, определите самостоятельно, куда сместится равновесие, если увеличить концентрацию вещества С; уменьшить концентрацию вещества D.
Изменяя концентрации компонентов, можно смещать равновесие в нужную сторону, увеличивая или уменьшая выход продуктов реакции; добиваясь более полного использования исходных веществ или, напротив
Для выполнения второго задания вспомним, что прямая реакция будет протекать до тех пор, пока не закончится один из компонентов А пли В. Из уравнения реакции видно, что реагенты вступают в реакцию в эквимолярных* количествах, к тому же их концентрации по условию задачи равны. Следовательно, вещества А и В, вступая в реакцию, закончатся одновременно. Из уравнения реакции также видно, что при превращении одного моля вещества A oбразуются два моля вещества C и один моль вещества D. Поэтому, к уже имеющемуся в системе количеству веществ С и D, добавится ещё некоторое их количество. Проведя несложный расчет, получим искомый результат:
[A] = [B] = 0 моль/л; [C] = 2 +2 = 4 моль/л; [D] = 2 +1 = 3 моль/л.
Проведите аналогичное рассуждение для третьего задания, помня о том, что вещества С и D вступают в реакцию в соотношении 2:1, и расчет нужно вести по количеству вещества, находящегося в недостатке (определите это вещество). Проделайте вычисления и получите результат:
[А] = [В] = 1+2/2 = 2 моль/л; [С] = 0 моль/л; [D] = 2-2/2 = 1 моль/л.
Константа равновесия реакции А+В С + D равна единице. Начальная концентрация [А]о = 0,02 моль/л. Сколько процентов вещества А подвергнется превращению, если начальные концентрации [В]о равны 0,02; 0,1; 0,2?
Обозначим через x равновесную концентрацию вещества А и запишем выражение для константы равновесия. Равновесная концентрация вещества В также будет равна х. Концентрации продуктов реакции (C и D) будут равны между собой и равны 0,02-х. (Покажите это, пользуясь уравнением реакции.)
Запишем выражение для константы равновесия.
Кравн. = (0,02 - х)(0,02 - х)/х2 = 1
Решив уравнение относительно х, получим результат: х = 0,01. Следовательно, в первом случае превращению подверглась половина вещества А (или 50%).
Для второго случая константа равновесия будет равна
Кравн. = (0,02 - х)(0,02 - х)/(0,1- (0,02 - х)) = 1
Самостоятельно получите это выражение и, решив уравнение, проверьте полученный результат (х = 0,003). Следовательно, в реакцию вступило (0,02 - 0,003) моль вещества А, что составляет 83,5%.
Решите задачу для третьего случая самостоятельно, а также решите эту же задачу, обозначив за х количество вещества, вступившего в реакцию.
Из полученных результатов можно сделать важный вывод. Для увеличения доли вещества, вступающего в реакцию при постоянной константе равновесия, нужно увеличить в системе количество второго реагента. Подобная задача встает, например, при утилизации отходов химическим путем.
При повышении температуры скорость как прямой, так и обратной реакции будет возрастать, но если прямая реакция эндотермическая (?Н > 0), то скорость прямой реакции будет возрастать сильнее, чем скорость обратной, и равновесие смещается в сторону образования продуктов, или вправо. При отрицательном тепловом эффекте прямой реакции (экзотермическая реакция), сильнее будет возрастать скорость обратной реакции, и равновесие сместится влево.
Рассмотрите самостоятельно все возможные случаи смещения равновесия при уменьшении температуры.
На рисунке 5 видно, что разность Е"a - Е"а равна?Н реакции, значит значение константы равновесия зависит от величины теплового эффекта реакции т.е. от того, является реакция эндо- или экзотермической.
Константа равновесия некоторой реакции при 293°К равна 5 10-3, а при 1000°К cocтавляет 2 10-6. Каков знак теплового эффекта этой реакции?
Из условия задачи следует, что при повышении температуры константа равновесия уменьшается. Используем выражение (22) и посмотрим, какой должен быть знак ДH реакции, чтобы константа уменьшилась.
Kравн. представлена показательной функцией, значение которой уменьшается с уменьшением аргумента, в нашем случае - значения выражения ДH/RT. Для того чтобы значение аргумента уменьшалось, нужно чтобы величина ДH была отрицательной. Следовательно, рассматриваемая реакция является экзотермической.
Изменение давления заметно сказывается на состоянии систем, включающих газообразные компоненты. В этом случае, в соответствии с газовыми законами происходит изменение объема системы, а это ведет к изменению концентрации газообразных веществ (или их парциальных давлений). Так, при увеличении давления объем будет уменьшаться, а концентрация газообразных веществ - увеличиваться. Увеличение концентрации ведет, как уже нам известно, к смещению равновесия в сторону расходования реагента, увеличившего свою концентрацию. В данном случае это можно сформулировать несколько иначе. ?При увеличении давления равновесие смещается в сторону меньшего количества газообразных веществ или, проще говоря, в сторону уменьшения числа молекул газообразных веществ. Концентрация твердых и жидких веществ от давления не меняется.
Рассмотрим классический пример синтеза аммиака из азота и водорода
3H2 + N2 - 2NH3 , (ДH < 0).
Поскольку система состоит только из газообразных веществ, а при образовании аммиака число молекул уменьшается, то при увеличении давления равновесие сместится вправо, в сторону большего выхода аммиака. Поэтому, промышленный синтез аммиака осуществляется при повышенном давлении.
Предложите самостоятельно температурные условия синтеза аммиака, зная тепловой эффект реакции и при условии максимального выхода продукта. Как эти условия соотносятся с кинетическими факторами протекания процесса?
Как повлияет на равновесие следующих реакций увеличение давления?
химический кинетика катализатор ингибитор
CaCO3(к.) - CaO(к.) + CO2(г.);
4Fe(к.) + 3O2(г.) - 2Fe2O3(к.).
В первой реакции газообразным является только углекислый газ CO2, поэтому при увеличении давления равновесие сместится влево, в сторону уменьшения количества газообразного вещества.
Второй случай рассмотрите самостоятельно.
Как нужно изменить давление в этих реакциях, чтобы добиться большего выхода продуктов?
Все случаи изменения состояния равновесной системы при внешних воздействиях можно обобщить, сформулировав принцип Ле Шателье:
Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Проверьте, выполняется ли принцип Ле Шателье во всех рассмотренных выше случаях.
Приведите самостоятельно примеры смещения равновесий при изменении внешних условий и объясните их на основе принципа Ле-Шателье.
Итак, нами рассмотрены основные вопросы, связанные с закономерностями протекания химических реакций. Знание этих закономерностей позволит осмысленно влиять на условия проведения тех или иных процессов с целью получения оптимального результата.
Вопросы для самоконтроля
- 1. Какие реакции называются обратимыми?
- 2. Как и почему изменяются скорости прямой и обратной реакций с течением времени?
- 3. Что называется химическим равновесием?
- 4. Какая величина количественно характеризует химическое равновесие?
- 5. От чего зависит величина константы равновесия: концентрация реагирующих веществ; природа реагирующих веществ; общее давление; температура; наличие катализатора?
- 6. Какие признаки характерны для истинного химического равновесия?
- 7. В чем отличие ложного химического равновесия от истинного равновесия?
- 8. Дайте формулировку принципа Ле Шателье.
- 9. Сформулируйте следствия из принципа Ле Шателье.
Изучение параметров системы, включающей исходные вещества и продукты реакции, позволяет выяснить, какие факторы смещают химическое равновесие и ведут к желаемым изменениям. На выводах Ле Шателье, Брауна и других ученых о способах проведения обратимых реакций основаны промышленные технологии, позволяющие осуществить ранее казавшиеся невозможными процессы, получить экономическую выгоду.
Разнообразие химических процессов
По особенностям теплового эффекта многие реакции относят к экзо- или эндотермическим. Первые идут с образованием теплоты, например, окисление углерода, гидратация концентрированной серной кислоты. Второй тип изменений связан с поглощением тепловой энергии. Примеры эндотермических реакций: распад карбоната кальция с образованием гашеной извести и углекислого газа, образование водорода и углерода при термическом разложении метана. В уравнениях экзо- и эндотермических процессов необходимо указывать тепловой эффект. Перераспределение электронов между атомами реагирующих веществ происходит в окислительно-восстановительных реакциях. Четыре типа химических процессов выделяют по особенностям реагентов и продуктов:
Для характеристики процессов важна полнота взаимодействия реагирующих соединений. Этот признак лежит в основе деления реакций на обратимые и необратимые.
Обратимость реакций
Обратимые процессы составляют большинство среди химических явлений. Образование конечных продуктов из реагентов является прямой реакцией. В обратной же исходные вещества получаются из продуктов своего разложения или синтеза. В реагирующей смеси возникает химическое равновесие, при котором получается столько же соединений, сколько разлагается исходных молекул. В обратимых процессах вместо знака «=» между реагентами и продуктами используются символы «↔» или «⇌». Стрелки могут быть неодинаковыми по длине, что связано с доминированием одной из реакций. В химических уравнениях можно указывать агрегатные характеристики веществ (г — газы, ж — жидкости, т — твердые). Огромное практическое значение имеют научно обоснованные приемы влияния на обратимые процессы. Так, производство аммиака стало рентабельным после создания условий, сдвигающих равновесие в сторону образования целевого продукта: 3Н 2(г) + N 2(г) ⇌ 2NH 3(г) . Необратимые явления приводят к появлению нерастворимого или малорастворимого соединения, образованию газа, покидающего сферу реакции. К таким процессам можно отнести ионный обмен, распад веществ.

Химическое равновесие и условия его смещения
На характеристики прямого и обратного процессов влияет несколько факторов. Один из них — время. Концентрация взятого для реакции вещества постепенно снижается, а конечного соединения — возрастает. Реакция прямого направления идет все медленнее, обратный процесс набирает скорость. В определенный промежуток два противоположных процесса идут синхронно. Взаимодействие между веществами происходит, но концентрации не меняются. Причина — динамическое химическое равновесие, установившееся в системе. Его сохранение или изменение зависит от:
- температурных условий;
- концентрации соединений;
- давления (для газов).
Смещение химического равновесия
В 1884 году выдающийся ученый из Франции А. Л. Ле Шателье предложил описание способов вывода системы из состояния динамического равновесия. В основе метода лежит принцип нивелирования действия внешних факторов. Ле Шателье обратил внимание, что в реагирующей смеси возникают процессы, компенсирующие влияние посторонних сил. Сформулированный французским исследователем принцип гласит, что изменение условий в состоянии равновесия благоприятствует протеканию реакции, ослабляющей постороннее воздействие. Смещение равновесия подчиняется этому правилу, оно соблюдается, когда меняется состав, температурные условия и давление. Технологии, основанные на выводах ученых, используются в промышленности. Многие химические процессы, считавшиеся практически неосуществимыми, проводятся благодаря способам смещения равновесия.

Влияние концентрации
Сдвиг равновесия происходит, если изъять из зоны взаимодействия определенные компоненты или дополнительно ввести порции вещества. Удаление продуктов из реакционной смеси обычно вызывает увеличение скорости их образования, добавление веществ, наоборот, приводит к их преимущественному распаду. В процессе этерификации для обезвоживания используют серную кислоту. При введении ее в сферу реакции повышается выход метилацетата: СН 3 СООН + СН 3 ОН ↔ СН 3 СООСН 3 + Н 2 О. Если добавлять кислород, взаимодействующий с диоксидом серы, то химическое равновесие смещается в сторону прямой реакции образования триоксида серы. Кислород связывается в молекулы SO 3 , его концентрация понижается, что согласуется с правилом Ле Шателье для обратимых процессов.

Изменение температуры
Процессы, идущие с поглощением или выделением тепла, — эндо- и экзотермические. Для смещения равновесия используется нагревание или отвод тепла от реагирующей смеси. Рост температуры сопровождается повышением скорости эндотермических явлений, в которых дополнительная энергия поглощается. Охлаждение приводит к преимуществу экзотермических процессов, идущих с выделением тепла. При взаимодействии диоксида углерода с углем нагревание сопровождается увеличением концентрации монооксида, а охлаждение ведет к преимущественному образованию сажи: СО 2(г) + С (т) ↔ 2СО (г) .
Влияние давления
Изменение давления — важный фактор для реагирующих смесей, включающих в себя газообразные соединения. Также следует обратить внимание на разницу объемов исходных и получившихся веществ. Понижение давления ведет к преимущественному протеканию явлений, в которых увеличивается общий объем всех компонентов. Рост давления направляет процесс в сторону снижения объема всей системы. Такая закономерность соблюдается в реакции образования аммиака: 0,5N 2(г) + 1,5Н 2(г) ⇌ NH 3(г) . Изменение давления не повлияет на химическое равновесие в тех реакциях, которые идут при неизменном объеме.

Оптимальные условия осуществления химического процесса
Создание условий для смещения равновесия во многом определяет развитие современных химических технологий. Практическое использование научной теории способствует получению оптимальных результатов производства. Наиболее яркий пример — получение аммиака: 0,5N 2(г) + 1,5Н 2(г) ⇌ NH 3(г) . Повышение содержания в системе молекул N 2 и Н 2 благоприятно для синтеза сложного вещества из простых. Реакция сопровождается выделением теплоты, поэтому снижение температуры вызовет увеличение концентрации NH 3 . Объем исходных компонентов больше, чем целевого продукта. Рост давления обеспечит повышение выхода NH 3 .

В условиях производства подбирают оптимальное соотношение всех параметров (температуры, концентрации, давления). Кроме того, имеет большое значение площадь соприкосновения между реагентами. В твердых гетерогенных системах увеличение поверхности ведет к росту скорости реакции. Катализаторы увеличивают скорость прямой и обратной реакции. Применение веществ с такими свойствами не приводит к смещению химического равновесия, но ускоряет его наступление.
Задача
Укажите, как повлияет:
а) повышение давления;
б) повышение температуры;
в) увеличение концентрации кислорода на равновесие системы:
2CO ( г ) + O 2 ( г ) ↔ 2CO 2 ( г ) + Q
Решение:
а) Изменение давлениясмещает равновесие реакций с участием газообразных веществ (г). Определим объёмы газообразных веществ до и после реакции по стехиометрическим коэффициентам:
По принципу Ле Шателье, при увеличении давления , равновесие смещается в сторону образовани я веществ, занимающих меньший о б ъ ём, следовательно равновесие сместится вправо, т.е. в сторону образования СО 2 , в сторону прямой реакции (→) .
б) По принципу Ле Шателье, при повышении температуры , равновесие смещается в сторону эндотермической реакции (- Q ), т.е. в сторону обратной реакции – реакции разложения СО 2 (←) , т.к. позакону сохранения энергии:
Q - 2 CO (г) + O 2 (г) ↔ 2 CO 2 (г) + Q
в) При увеличении концентрации кислорода равновесие системы смещается в сторону получения СО 2 (→) т.к. увеличение концентрации реагентов (жидких или газообразных) смещает в сторону продуктов, т.е. в сторону прямой реакции.
Дополнительно:
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе:
2 SO 2 (г) + O 2 (г) = 2 SO 3 (г)
если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ: [ SO 2 ]= a , [О 2 ] = b , [ SO 3 ] = с. Согласно закону действия масс скорости v прямой и обратной реакции до изменения объема:
v пр = Ка 2 b
v обр = К 1 с 2 .
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [ SO 2 ] = 3 а , [О 2 ] = 3 b ; [ SO 3 ] = 3 с . При новых концентрациях скорости v ’ прямой и обратной реакции:
v ’ пр = К (3 а ) 2 (3 b ) = 27 Ка 2 b
v ’ обр = К 1 (3 с ) 2 = 9 К 1 с 2
Отсюда:

Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в девять раз. Равновесие системы сместилось в сторону образования SO 3 .
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 о С, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:

Следовательно, скорость реакции ν Т 2 при температуре 70 о С больше скорости реакции ν Т 1 при температуре 30 о С в 16 раз.
Пример 3. Константа равновесия гомогенной системы:
СО(г) + Н 2 О(г) = СО 2 (г) + Н 2 (г)
при 850 о С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО] исх =3 моль/л, [Н 2 О] исх = 2 моль/л.
Решение. При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
v пр = К 1 [СО][Н 2 О]
v обр = К 2 [СО 2 ][Н 2 ]

В условии задачи даны исходные концентрации, тогда как в выражение К р входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрации [СО 2 ] р = х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н 2 О расходуется для образования по х молей СО 2 и Н 2 . Следовательно, равновесные концентрации всех четырех веществ:
[СО
2
]
р
= [Н
2
]
р
=
х
моль/л;
[СО] р = (3 – х ) моль/л;
[Н 2 О] р = (2 – х ) моль/л.
Зная константу равновесия, находим значение х , а затем исходные концентрации всех веществ:

Таким образом, искомые равновесные концентрации:
[СО 2 ] р = 1,2 моль/л;
[Н 2 ] р = 1,2 моль/л;
[СО] р = 3 – 1,2 = 1,8 моль/л;
[Н 2 О] р = 2 – 1,2 = 0,8 моль/л.
Пример 4. При некоторой температуре равновесные концентрации в системе
2CO (г) + O 2 (г) ↔ 2CO 2 (г) составляли: = 0,2 моль/л, = 0,32 моль/л, = 0,16 моль/л. Определить константу равновесия при этой температуре и исходные концентрации CO и O 2 , если исходная смесь не содержала СО 2 .
Решение:
1). Так как в условии задачи даны равновесные концентрации, то константа равновесия равна 2:
![]()
2). Если исходная смесь не содержала СО 2 , то на момент химического равновесия в системе образовалось 0,16 моль СО 2 .
По УХР:
2CO (г) + O 2(г) ↔ 2CO 2(г)
На образование 0,16 моль СО 2 затрачено:
υ прореагировавшее (СО)=υ(CO 2)=0,16 моль
υ прореагировавшее (О 2)=1/2υ(CO 2)=0,08 моль
Следовательно,
υ исходное = υ прореагировавшее + υ равновесное
υ исходное (СО)=0,16 +0,2 = 0,36 моль
υ исходное (O 2)=0,08 +0,32 = 0,4 моль
|
Вещество |
CO 2 |
||
|
С исходная |
0,36 |
||
|
С прореагировавшая |
0,16 |
0,08 |
0,16 |
|
С равновесная |
0,32 |
0,16 |
Пример 5. Определить равновесную концентрацию HI в системе
H 2(г) + I 2(г) ↔ 2HI (г) ,
если при некоторой температуре константа равновесия равна 4, а исходные концентрации H 2 , I 2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени образовалось x моль/л HI
|
Вещество |
H 2 |
I 2 |
|
|
с исходн. , моль/л |
|||
|
с прореагир. , моль/л |
х/2 |
х/2 |
|
|
c равн. , моль/л |
1-x/2 |
PCl 5 (г) = РС l 3 (г) + С l 2 (г); Δ Н = + 92,59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложения PCl 5 ? Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесно, определяется по принципу Ле Шателье: а) так как реакция разложения PCl 5 эндотермическая (ΔН > 0) то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение РСl 5 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РС l 5 , так и уменьшением концентрации РСl 3 или Сl 2 . |
Химические реакции бывают обратимые и необратимые.
Необратимыми реакциями называют такие реакции, которые идут только в одном (прямом →) направлении:
т.е. если некоторая реакция A + B = C + D необратима, это значит, что обратная реакция C + D = A + B не протекает.
Обратимые реакции – это такие реакции, которые идут как в прямом, так и в обратном направлении (⇄):
т.е., например, если некая реакция A + B = C + D обратима, это значит, что одновременно протекает как реакция A + B → C + D (прямая), так и реакция С + D → A + B (обратная).
По сути, т.к. протекают как прямая, так и обратная реакции, реагентами (исходными веществами) в случае обратимых реакций могут быть названы как вещества левой части уравнения, так и вещества правой части уравнения. То же самое касается и продуктов.
Для любой обратимой реакции возможна ситуация, когда скорость прямой и обратной реакций равны. Такое состояние называют состоянием равновесия .
В состоянии равновесия концентрации как всех реагентов, так и всех продуктов неизменны. Концентрации продуктов и реагентов в состоянии равновесия называют равновесными концентрациями .
Смещение химического равновесия под действием различных факторов
Вследствие таких внешних воздействий на систему, как изменение температуры, давления или концентрации исходных веществ или продуктов, равновесие системы может быть нарушено. Однако после прекращения этого внешнего воздействия система через некоторое время перейдет в новое состояние равновесия. Такой переход системы из одного равновесного состояния в другое равновесное состояние называют смещением (сдвигом) химического равновесия .
Для того чтобы уметь определять, каким образом сдвигается химическое равновесие при том или ином типе воздействия, удобно пользоваться принципом Ле Шателье:
Если на систему в состоянии равновесия оказать какое-либо внешнее воздействие, то направление смещения химического равновесия будет совпадать с направлением той реакции, которая ослабляет эффект от оказанного воздействия.
Влияние температуры на состояние равновесия
При изменении температуры равновесие любой химической реакции смещается. Связано это с тем, что любая реакция имеет тепловой эффект. При этом тепловые эффекты прямой и обратной реакции всегда прямо противоположны. Т.е. если прямая реакция является экзотермической и протекает с тепловым эффектом, равным +Q, то обратная реакция всегда эндотермична и имеет тепловой эффект, равный –Q.
Таким образом, в соответствии с принципом Ле Шателье, если мы повысим температуру некоторой системы, находящейся в состоянии равновесия, то равновесие сместится в сторону той реакции, при протекании которой температура понижается, т.е. в сторону эндотермической реакции. И аналогично, в случае, если мы понизим температуру системы в состоянии равновесия, равновесие сместится в сторону той реакции, в результате протекания которой температура будет повышаться, т.е. в сторону экзотермической реакции.
Например, рассмотрим следующую обратимую реакцию и укажем, куда сместится ее равновесие при понижении температуры:
Как видно из уравнения выше, прямая реакция является экзотермической, т.е. в результате ее протекания выделяется тепло. Следовательно, обратная реакция будет эндотермической, то есть протекает с поглощением тепла. По условию температуру понижают, следовательно, смещение равновесия будет происходить вправо, т.е. в сторону прямой реакции.
Влияние концентрации на химическое равновесие
Повышение концентрации реагентов в соответствии с принципом Ле Шателье должно приводить к смещению равновесия в сторону той реакции, в результате которой реагенты расходуются, т.е. в сторону прямой реакции.
И наоборот, если концентрацию реагентов понижают, то равновесие будет смещаться в сторону той реакции, в результате которой реагенты образуются, т.е. сторону обратной реакции (←).
Аналогичным образом влияет и изменение концентрации продуктов реакции. Если повысить концентрацию продуктов, равновесие будет смещаться в сторону той реакции, в результате которой продукты расходуются, т.е. в сторону обратной реакции (←). Если же концентрацию продуктов, наоборот, понизить, то равновесие сместится в сторону прямой реакции (→), для того чтобы концентрация продуктов возросла.
Влияние давления на химическое равновесие
В отличие от температуры и концентрации, изменение давления оказывает влияние на состояние равновесия не каждой реакции. Для того чтобы изменение давления приводило к смещению химического равновесия, суммы коэффициентов перед газообразными веществами в левой и в правой частях уравнения должны быть разными.
Т.е. из двух реакций:
изменение давления способно повлиять на состояние равновесия только в случае второй реакции. Поскольку сумма коэффициентов перед формулами газообразных веществ в случае первого уравнения слева и справа одинаковая (равна 2), а в случае второго уравнения – различна (4 слева и 2 справа).
Отсюда, в частности, следует, что если среди и реагентов, и продуктов отсутствуют газообразные вещества, то изменение давления никак не повлияет на текущее состояние равновесия. Например, давление никак не повлияет на состояние равновесия реакции:
Если же слева и справа количество газообразных веществ различается, то повышение давления будет приводить к смещению равновесия в сторону той реакции, при протекании которой объем газов уменьшается, а понижение давления – в сторону той реакции, в результате которой объем газов увеличивается.
Влияние катализатора на химическое равновесие
Поскольку катализатор в равной мере ускоряет как прямую, так и обратную реакции, то его наличие или отсутствие никак не влияет на состояние равновесия.
Единственное, на что может повлиять катализатор, — это на скорость перехода системы из неравновесного состояния в равновесное.
Воздействие всех указанных выше факторов на химическое равновесие сведено ниже в таблицу-шпаргалку, в которую поначалу можно подглядывать при выполнении заданий на равновесия . Однако же пользоваться на экзамене ей не будет возможности, поэтому после разбора нескольких примеров с ее помощью, ее следует выучить и тренироваться решать задания на равновесия, уже не подглядывая в нее:
Обозначения: T – температура, p – давление, с – концентрация, — повышение, ↓ — понижение
| T | Т — равновесие смещается в сторону эндотермической реакции |
| ↓Т — равновесие смещается в сторону экзотермической реакции | |
| p | p — равновесие смещается в сторону реакции с меньшей суммой коэффициентов перед газообразными веществами |
| ↓p — равновесие смещается в сторону реакции с большей суммой коэффициентов перед газообразными веществами | |
| c | c (реагента) – равновесие смещается в сторону прямой реакции (вправо) |
| ↓c (реагента) – равновесие смещается в сторону обратной реакции (влево) | |
| c (продукта) – равновесие смещается в сторону обратной реакции (влево) | |
| ↓c (продукта) – равновесие смещается в сторону прямой реакции (вправо) | |
| На равновесие не влияет!!! |
В соответствии с принципом Ле Шателье, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то равновесие сместится в сторону протекания той реакции, которая ослабляет это воздействие.
На примере
3H 2 + N 2 2NH 3 – DH.
1. Влияние концентрации . Если увеличить концентрацию исходных веществ, то равновесие сместится в сторону образования продуктов и, наоборот.
Если уменьшить концентрации исходных веществ N 2 и Н 2 , это приведет к смещению равновесия справа налево, в результате концентрации N 2 и Н 2 вновь увеличатся за счет разложения аммиака.
2. Влияние давления. При этом учитываются только газообразные участники реакции. При увеличении давления равновесие смещается в сторону системы, состоящей из меньшего числа моль газообразных веществ.
Увеличение давления системы приведет к смещению равновесия слева направо, т.к. в левой части общее число моль газов 4, а в правой 2.
3. Влияние температуры. Зависит от теплового эффекта реакции.
Химические уравнения, в которых указан тепловой эффект реакций называются термохимическими уравнениями . В термохимических уравнениях химических реакций тепловой эффект указывают при помощи величины DH, которая называется изменением энтальпии (теплосодержания) реакции. Энтальпия является мерой энергии, накапливаемой веществом при его образовании.
–DH, теплота выделяется, т.е. реакция – экзотермическая;
DH, теплота поглощается, т.е. реакция – эндотермическая;
Прямая реакция экзотермическая, т.е. при повышении температуры равновесие будет смещаться справа налево, в сторону эндотермической реакции.
4. Влияние катализатора . Катализаторы одинаково ускоряют как прямую, так и обратную реакцию, и поэтому не смещают химическое равновесие, а только способствуют более быстрому достижению равновесного состояния.
Задание. Газовая системе А + В С – DH. Какое влияние на равновесную концентрацию вещества С окажет:
а) увеличение давления. В левой части 2 моль веществ. В правой 1 моль, т.е. равновесие смещается слева направо в сторону образования вещества С, концентрация С увеличивается.(®)
б) увеличение концентрации вещества А. Равновесие смещается слева направо в сторону образования вещества С, концентрация С увеличивается.(®).
в) повышение температуры. Прямая экзо, обратная – эндотермическая. Равновесие сместится справа налево ().
Задание. Как повлияет на равновесие системы увеличение давления?
Fe 3 O 4(тв) + СО (г) 3FeO + CO 2(г)
Равновесие в системе не сместится.
Задание. Каким образом надо изменить температуру, давление и концентрацию, чтобы сместить равновесие в сторону прямой реакции?
PCl 5(г) PCl 3(г) + Cl 2(г) + 92,59 кДж
а) реакция эндотермическая, температуру надо повысить.
б) давление надо уменьшить
в) либо увеличить концентрацию PCl 5 , либо уменьшить концентрации PCl 3 и Cl 2 .
Задание. 2SO 2 (г)+О 2 (г) Û 2SO 3 (ж). Какое влияние на равновесное состояние окажут:
а) увеличение давления;
При протекании прямой реакции количество газообразных веществ в системе уменьшается (из 2 моль газа SO 2 и 1 моль газа О 2 образуется жидкость SO 3). Повышение давления приведет к смещению равновесия в сторону образования меньшего количества газообразных веществ, т. е. SO 3 . (®).
б) уменьшение концентрации оксида серы (VI)?
Уменьшение концентрации SO 3 (отвод продукта из реакционной системы) вызовет смещение равновесия в сторону образования SO 3 . (®).
Задание. А + В Û 2С –
Какое влияние окажут на равновесное состояние.