Diezgan bieži skolēniem un studentiem nākas izdomāt t.s. jonu vienādojumi reakcijas. Konkrēti, šai tēmai ir veltīta 31. problēma, kas ierosināta vienotajā valsts eksāmenā ķīmijā. Šajā rakstā mēs detalizēti apspriedīsim īsu un pilnīgu jonu vienādojumu rakstīšanas algoritmu, mēs analizēsim daudzus piemērus dažādi līmeņi grūtības.
Kāpēc ir nepieciešami jonu vienādojumi
Atgādināšu, ka daudzām vielām izšķīdinot ūdenī (un ne tikai ūdenī!) notiek disociācijas process - vielas sadalās jonos. Piemēram, HCl molekulas iekšā ūdens vide sadalās ūdeņraža katjonos (H +, precīzāk, H 3 O +) un hlora anjonos (Cl -). Nātrija bromīds (NaBr) ūdens šķīdumā atrodas nevis molekulu, bet hidratētu Na + un Br - jonu veidā (starp citu, joni ir arī cietā nātrija bromīdā).
Rakstot "parastos" (molekulāros) vienādojumus, mēs neņemam vērā, ka reakcijā nonāk nevis molekulas, bet joni. Piemēram, šeit ir vienādojums reakcijai starp sālsskābe un nātrija hidroksīds:
HCl + NaOH = NaCl + H 2 O. (1)
Protams, šī diagramma ne visai pareizi apraksta procesu. Kā jau teicām, ūdens šķīdumā praktiski nav HCl molekulu, bet ir H + un Cl - joni. Tas pats attiecas uz NaOH. Labāk būtu uzrakstīt sekojošo:
H + + Cl - + Na + + OH - = Na + + Cl - + H 2 O. (2)
Tā tas ir pilnīgs jonu vienādojums. "Virtuālo" molekulu vietā mēs redzam daļiņas, kas faktiski atrodas šķīdumā (katjoni un anjoni). Mēs nepakavēsimies pie jautājuma, kāpēc mēs esam uzrakstījuši H 2 O molekulārā formā. Tas tiks paskaidrots nedaudz vēlāk. Kā redzat, nav nekā sarežģīta: mēs esam aizstājuši molekulas ar joniem, kas veidojas to disociācijas laikā.
Tomēr pat pilnīgs jonu vienādojums nav ideāls. Patiesi, ieskatieties tuvāk: vienādojuma (2) kreisajā un labajā daļā ir identiskas daļiņas - Na + katjoni un Cl - anjoni. Šie joni reakcijas laikā nemainās. Kāpēc tad tie vispār ir vajadzīgi? Noņemsim tos un saņemsim īss jonu vienādojums:
H + + OH - = H 2 O. (3)
Kā redzat, tas viss ir saistīts ar H + un OH - jonu mijiedarbību ar ūdens veidošanos (neitralizācijas reakcija).
Visi pilnīgie un īsie jonu vienādojumi tiek pierakstīti. Ja eksāmenā ķīmijā atrisinātu 31. uzdevumu, par to iegūtu maksimālo atzīmi - 2 balles.
Tātad vēlreiz par terminoloģiju:
- HCl + NaOH = NaCl + H 2 O - molekulārais vienādojums ("parastais" vienādojums, shematiski atspoguļo reakcijas būtību);
- H + + Cl - + Na + + OH - = Na + + Cl - + H 2 O - pilns jonu vienādojums (redzamas reālas daļiņas šķīdumā);
- H + + OH - = H 2 O - īss jonu vienādojums (mēs noņēmām visus "atkritumus" - daļiņas, kas nepiedalās procesā).
Jonu vienādojumu rakstīšanas algoritms
- Mēs sastādām reakcijas molekulāro vienādojumu.
- Visas daļiņas, kas šķīdumā disociējas līdz ievērojamai pakāpei, tiek rakstītas kā joni; vielas, kas nav pakļautas disociācijai, mēs atstājam "molekulu formā".
- Mēs noņemam no abām vienādojuma daļām t.s. novērotāja joni, t.i., daļiņas, kas nepiedalās procesā.
- Pārbaudām koeficientus un iegūstam galīgo atbildi – īsu jonu vienādojumu.
1. piemērs. Uzrakstiet pilnīgu un īsu jonu vienādojumu, kas apraksta bārija hlorīda un nātrija sulfāta ūdens šķīdumu mijiedarbību.
Risinājums. Mēs rīkosimies saskaņā ar piedāvāto algoritmu. Vispirms izveidosim molekulāro vienādojumu. Bārija hlorīds un nātrija sulfāts ir divi sāļi. Apskatīsim uzziņu grāmatas sadaļu "Neorganisko savienojumu īpašības". Mēs redzam, ka sāļi var mijiedarboties viens ar otru, ja reakcijas laikā veidojas nogulsnes. Pārbaudīsim:
2. vingrinājums. Pabeidziet vienādojumus šādām reakcijām:
- KOH + H 2 SO 4 \u003d
- H 3 PO 4 + Na 2 O \u003d
- Ba(OH) 2 + CO 2 =
- NaOH + CuBr 2 =
- K 2 S + Hg (NO 3) 2 \u003d
- Zn + FeCl 2 =
3. vingrinājums. Uzrakstiet molekulāros vienādojumus reakcijām (ūdens šķīdumā) starp: a) nātrija karbonātu un slāpekļskābi, b) niķeļa (II) hlorīdu un nātrija hidroksīdu, c) ortofosforskābi un kalcija hidroksīdu, d) sudraba nitrātu un kālija hlorīdu, e. ) fosfora oksīds (V) un kālija hidroksīds.
Es patiesi ceru, ka jums nebija problēmu, izpildot šos trīs uzdevumus. Ja tas tā nav, jums jāatgriežas pie tēmas " Ķīmiskās īpašības galvenās neorganisko savienojumu klases".
Kā pārvērst molekulāro vienādojumu par pilnīgu jonu vienādojumu
Sākas interesantākais. Mums jāsaprot, kuras vielas jāraksta kā joni un kuras jāatstāj "molekulārā formā". Jums jāatceras sekojošais.
Jonu formā rakstiet:
- šķīstošie sāļi (uzsveru, ka ūdenī labi šķīst tikai sāļi);
- sārmi (atgādināšu, ka ūdenī šķīstošās bāzes sauc par sārmiem, bet ne par NH 4 OH);
- stiprās skābes (H 2 SO 4, HNO 3, HCl, HBr, HI, HClO 4, HClO 3, H 2 SeO 4, ...).
Kā redzat, šo sarakstu ir viegli atcerēties: tajā ir iekļautas stipras skābes un bāzes un visi šķīstošie sāļi. Starp citu, īpaši modriem jaunajiem ķīmiķiem, kuri var būt sašutuši par to, ka spēcīgi elektrolīti (nešķīstošie sāļi) nav iekļauti šajā sarakstā, varu pateikt sekojošo: nešķīstošo sāļu NEiekļūšana šajā sarakstā nemaz nenoraida fakts, ka tie ir spēcīgi elektrolīti.
Visām pārējām vielām jonu vienādojumos jābūt molekulu veidā. Tie prasīgie lasītāji, kurus neapmierina neskaidrais termins "visas citas vielas", un kuri, sekojot slavenas filmas varoņa piemēram, pieprasa "paziņot pilns saraksts Es sniedzu šādu informāciju.
Molekulu formā ierakstiet:
- visi nešķīstošie sāļi;
- visas vājās bāzes (ieskaitot nešķīstošos hidroksīdus, NH 4 OH un līdzīgas vielas);
- visas vājās skābes (H 2 CO 3, HNO 2, H 2 S, H 2 SiO 3, HCN, HClO, gandrīz visas organiskās skābes ...);
- vispār visi vājie elektrolīti (arī ūdens!!!);
- oksīdi (visu veidu);
- visi gāzveida savienojumi (jo īpaši H 2 , CO 2 , SO 2 , H 2 S, CO);
- vienkāršas vielas (metāli un nemetāli);
- gandrīz visi organiskie savienojumi(izņēmums - organisko skābju ūdenī šķīstošie sāļi).
Fu, es nedomāju, ka esmu kaut ko aizmirsis! Lai gan vieglāk, manuprāt, atcerēties sarakstu Nr.1. No fundamentāli svarīgajiem sarakstā Nr.2 vēlreiz atzīmēšu ūdeni.
Trenējamies!
2. piemērs. Izveidojiet pilnīgu jonu vienādojumu, kas apraksta vara (II) hidroksīda un sālsskābes mijiedarbību.
Risinājums. Sāksim, protams, ar molekulāro vienādojumu. Vara (II) hidroksīds ir nešķīstoša bāze. Visas nešķīstošās bāzes reaģē ar stiprām skābēm, veidojot sāli un ūdeni:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O.
Un tagad mēs noskaidrojam, kuras vielas rakstīt jonu formā un kuras - molekulu formā. Iepriekš minētie saraksti mums palīdzēs. Vara (II) hidroksīds ir nešķīstoša bāze (sk. šķīdības tabulu), vājš elektrolīts. Nešķīstošās bāzes ir rakstītas molekulārā formā. HCl- stipra skābe, šķīdumā gandrīz pilnībā sadalās jonos. CuCl 2 ir šķīstošs sāls. Mēs rakstām jonu formā. Ūdens – tikai molekulu veidā! Mēs iegūstam pilnu jonu vienādojumu:
Cu (OH) 2 + 2H + + 2Cl - \u003d Cu 2+ + 2Cl - + 2H 2 O.
3. piemērs. Uzrakstiet pilnīgu jonu vienādojumu oglekļa dioksīda reakcijai ar NaOH ūdens šķīdumu.
Risinājums. Oglekļa dioksīds ir tipisks skābs oksīds, NaOH ir sārms. Kad skābie oksīdi mijiedarbojas ar sārmu ūdens šķīdumiem, veidojas sāls un ūdens. Mēs sastādām molekulārās reakcijas vienādojumu (starp citu, neaizmirstiet par koeficientiem):
CO 2 + 2NaOH \u003d Na 2 CO 3 + H 2 O.
CO 2 - oksīds, gāzveida savienojums; saglabāt molekulāro formu. NaOH - spēcīga bāze (sārms); rakstīts jonu formā. Na 2 CO 3 - šķīstošs sāls; rakstiet jonu formā. Ūdens ir vājš elektrolīts, praktiski nedisociējas; atstājiet to molekulārā formā. Mēs iegūstam sekojošo:
CO 2 + 2Na + + 2OH - \u003d Na 2+ + CO 3 2- + H 2 O.
4. piemērs. Nātrija sulfīds ūdens šķīdumā reaģē ar cinka hlorīdu, veidojot nogulsnes. Uzrakstiet šīs reakcijas pilno jonu vienādojumu.
Risinājums. Nātrija sulfīds un cinka hlorīds ir sāļi. Kad šie sāļi mijiedarbojas, cinka sulfīds nogulsnējas:
Na 2 S + ZnCl 2 \u003d ZnS ↓ + 2NaCl.
Es nekavējoties pierakstīšu pilnu jonu vienādojumu, un jūs pats to analizēsit:
2Na + + S 2- + Zn 2+ + 2Cl - = ZnS↓ + 2Na + + 2Cl - .
Šeit ir daži uzdevumi, kas jums jāveic patstāvīgs darbs un neliels tests.
4. vingrinājums. Uzrakstiet molekulāros un pilno jonu vienādojumus šādām reakcijām:
- NaOH + HNO3 =
- H 2 SO 4 + MgO =
- Ca(NO 3) 2 + Na 3 PO 4 =
- CoBr 2 + Ca(OH) 2 =
5. vingrinājums. Uzrakstiet pilnīgus jonu vienādojumus, kas apraksta mijiedarbību starp: a) slāpekļa oksīds (V) ar bārija hidroksīda ūdens šķīdumu, b) cēzija hidroksīda šķīdums ar jodūdeņražskābi, c) vara sulfāta un kālija sulfīda ūdens šķīdumi, d) kalcija hidroksīds. un ūdens šķīdums dzelzs (III) nitrāts.
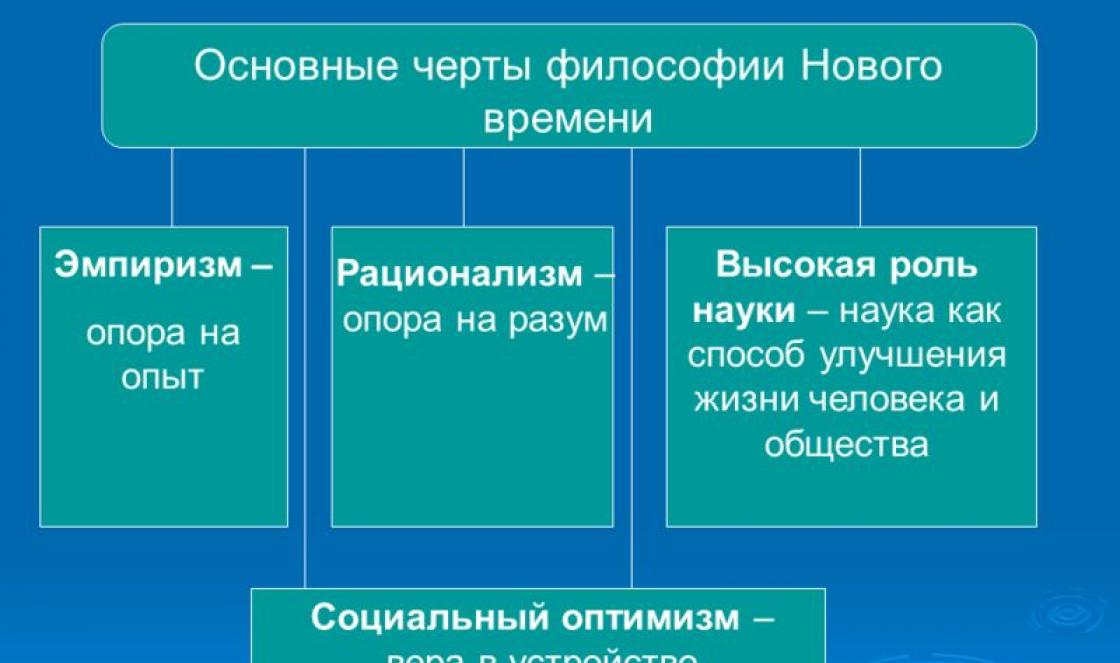
Reakcijas starp dažāda veida ķīmiskām vielām un elementiem ir viens no galvenajiem ķīmijas mācību priekšmetiem. Lai saprastu, kā sastādīt reakcijas vienādojumu un izmantot tos saviem mērķiem, jums ir nepieciešams diezgan dziļi saprast visus vielu mijiedarbības modeļus, kā arī procesus ar ķīmiskām reakcijām.
Vienādojumu rakstīšana
Viens veids, kā izteikt ķīmisko reakciju, ir ķīmiskais vienādojums. Tajā ir izejvielas un produkta formula, koeficienti, kas parāda, cik molekulu ir katrai vielai. Visas zināmās ķīmiskās reakcijas ir sadalītas četros veidos: aizstāšana, kombinācija, apmaiņa un sadalīšanās. Starp tiem ir: redokss, eksogēns, jonu, atgriezenisks, neatgriezenisks utt.
Uzziniet vairāk par to, kā rakstīt vienādojumus ķīmiskās reakcijas:
- Ir nepieciešams noteikt to vielu nosaukumus, kas reakcijā mijiedarbojas viena ar otru. Mēs tos rakstām vienādojuma kreisajā pusē. Kā piemēru apsveriet ķīmisko reakciju, kas notika starp sērskābi un alumīniju. Mums ir reaģenti kreisajā pusē: H2SO4 + Al. Tālāk uzrakstiet vienādības zīmi. Ķīmijā jūs varat redzēt bultiņas zīmi, kas norāda uz labo pusi, vai divas pretējās bultiņas, kas nozīmē "atgriezeniskums". Metāla un skābes mijiedarbības rezultāts ir sāls un ūdeņradis. Pēc reakcijas iegūtos produktus uzrakstiet aiz "vienādības" zīmes, tas ir, labajā pusē. H2SO4+Al= H2+Al2(SO4)3. Tātad, mēs varam redzēt reakcijas shēmu.
- Sastādīšanai ķīmiskais vienādojums jums jāatrod koeficienti. Atgriezīsimies pie iepriekšējās diagrammas. Apskatīsim tā kreiso pusi. Sērskābe satur ūdeņraža, skābekļa un sēra atomus aptuvenā attiecībā 2:4:1. Labajā pusē sālī ir 3 sēra atomi un 12 skābekļa atomi. Gāzes molekulā ir divi ūdeņraža atomi. Kreisajā pusē šo elementu attiecība ir 2:3:12
- Lai izlīdzinātu alumīnija (III) sulfāta sastāvā esošo skābekļa un sēra atomu skaitu, vienādojuma kreisajā pusē skābes priekšā ir jāievieto koeficients 3. Tagad mums ir 6 ūdeņraža atomi. kreisajā pusē. Lai izlīdzinātu ūdeņraža elementu skaitu, vienādojuma labajā pusē ūdeņraža priekšā jāievieto 3.
- Tagad atliek tikai izlīdzināt alumīnija daudzumu. Tā kā sāls sastāvā ir divi metāla atomi, tad kreisajā pusē alumīnija priekšā iestatām koeficientu 2. Rezultātā iegūsim šīs shēmas reakcijas vienādojumu: 2Al + 3H2SO4 = Al2 (SO4) 3 + 3H2
Izpratne par reakcijas vienādojuma rakstīšanas pamatprincipiem ķīmiskās vielas, turpmāk nesagādās lielas grūtības pierakstīt jebkuru, pat eksotiskāko, no ķīmijas, reakcijas viedokļa.
Pierakstiet ķīmisko vienādojumu. Piemēram, apsveriet šādu reakciju:
- C 3 H 8 + O 2 –> H 2 O + CO 2
- Šī reakcija apraksta propāna (C 3 H 8) sadegšanu skābekļa klātbūtnē, veidojot ūdeni un oglekļa dioksīdu (oglekļa dioksīdu).
Pierakstiet katra elementa atomu skaitu. Dariet to abām vienādojuma pusēm. Ievērojiet apakšindeksus blakus katram elementam, lai noteiktu kopējo atomu skaitu. Pierakstiet katra vienādojuma elementa simbolu un atzīmējiet atbilstošo atomu skaitu.
- Piemēram, aplūkojamā vienādojuma labajā pusē saskaitīšanas rezultātā iegūstam 3 skābekļa atomus.
- Kreisajā pusē mums ir 3 oglekļa atomi (C 3), 8 ūdeņraža atomi (H 8) un 2 skābekļa atomi (O 2).
- Labajā pusē mums ir 1 oglekļa atoms (C), 2 ūdeņraža atomi (H 2) un 3 skābekļa atomi (O + O 2).
Atstājiet ūdeņradi un skābekli vēlākam laikam, jo tie ir daļa no vairākiem savienojumiem kreisajā un labajā pusē. Ūdeņradis un skābeklis ir daļa no vairākām molekulām, tāpēc vislabāk tos līdzsvarot.
- Pirms ūdeņraža un skābekļa līdzsvarošanas jums būs vēlreiz jāskaita atomi, jo var būt nepieciešami papildu faktori, lai līdzsvarotu citus elementus.
Sāciet ar retāk sastopamo elementu. Ja nepieciešams līdzsvarot vairākus elementus, izvēlieties vienu, kas ir daļa no vienas reaģentu molekulas un vienas reakcijas produktu molekulas. Tāpēc pirmā lieta, kas jādara, ir līdzsvarot oglekli.
Lai iegūtu līdzsvaru, pievienojiet koeficientu pirms viena oglekļa atoma. Novietojiet koeficientu viena oglekļa priekšā vienādojuma labajā pusē, lai līdzsvarotu to ar 3 oglēm kreisajā pusē.
- C 3 H 8 + O 2 –> H 2 O + 3 CO 2
- Koeficients 3 oglekļa priekšā vienādojuma labajā pusē norāda, ka ir trīs oglekļa atomi, kas atbilst trim oglekļa atomiem, kas iekļauti propāna molekulā kreisajā pusē.
- Ķīmiskajā vienādojumā jūs varat mainīt koeficientus atomu un molekulu priekšā, bet apakšindeksiem ir jāpaliek nemainīgiem.
Pēc tam līdzsvaro ūdeņraža atomus. Pēc tam, kad esat izlīdzinājis oglekļa atomu skaitu kreisajā un labajā pusē, ūdeņradis un skābeklis palika nelīdzsvaroti. Vienādojuma kreisajā pusē ir 8 ūdeņraža atomi, tādam pašam skaitam jābūt arī labajā pusē. Sasniedziet to ar attiecību.
- C 3 H 8 + O 2 –> 4 H 2 O + 3CO 2
- Labajā pusē esam pievienojuši koeficientu 4, jo apakšindekss parāda, ka mums jau ir divi ūdeņraži.
- Ja jūs reizinat koeficientu 4 ar apakšindeksu 2, jūs iegūstat 8.
- Rezultātā labajā pusē tiek iegūti 10 skābekļa atomi: 3x2=6 atomi trīs 3CO 2 molekulās un vēl četri atomi četrās ūdens molekulās.
I daļa
1. Lomonosova-Lavuazjē likums - vielu masas saglabāšanas likums:
2. Ķīmiskās reakcijas vienādojumi irķīmiskās reakcijas nosacīts apzīmējums, izmantojot ķīmiskās formulas un matemātiskie simboli.
3. Ķīmiskajam vienādojumam jāatbilst likumam vielu masas saglabāšana, ko panāk, sakārtojot koeficientus reakcijas vienādojumā.
4. Ko parāda ķīmiskais vienādojums?
1) Kādas vielas reaģē.
2) Kādas vielas veidojas rezultātā.
3) Reakcijā esošo vielu kvantitatīvās attiecības, t.i., reaģējošo un radušos vielu daudzums reakcijā.
4) Ķīmiskās reakcijas veids.
5. Koeficientu sakārtošanas noteikumi ķīmiskās reakcijas shēmā bārija hidroksīda un fosforskābes mijiedarbības piemērā ar bārija fosfāta un ūdens veidošanos.
a) Pierakstiet reakcijas shēmu, t.i., reaģējošo un veidojošo vielu formulas:
b) sāk izlīdzināt reakcijas shēmu ar sāls formulu (ja pieejama). Tajā pašā laikā atcerieties, ka vairāki kompleksi joni bāzes vai sāls sastāvā ir norādīti iekavās, un to skaits ir norādīts ar indeksiem ārpus iekavām:
c) izlīdzināt ūdeņradi priekšpēdējā pagriezienā:
d) pēdējo izlīdziniet skābekli - tas ir koeficientu pareizas izvietojuma rādītājs.
Pirms vienkāršas vielas formulas var uzrakstīt daļskaitļu koeficientu, pēc kura vienādojums jāpārraksta ar dubultotiem koeficientiem.

II daļa
1. Sastādiet reakciju vienādojumus, kuru shēmas ir:

2. Uzrakstiet ķīmisko reakciju vienādojumus:

3. Izveidot atbilstību starp shēmu un ķīmiskās reakcijas koeficientu summu.

4. Izveidot atbilstību starp izejmateriāliem un reakcijas produktiem.

5. Ko parāda šādas ķīmiskās reakcijas vienādojums:
1) ir reaģējuši vara hidroksīds un sālsskābe;
2) Veidojas sāls un ūdens reakcijas rezultātā;
3) Koeficienti pirms izejas vielām 1 un 2.
6. Izmantojot šo diagrammu, uzrakstiet vienādojumu ķīmiskai reakcijai, izmantojot daļskaitļa koeficienta dubultošanu:

7. Ķīmiskās reakcijas vienādojums:
4P+5O2=2P2O5
parāda izejvielu un produktu vielu daudzumu, to masu vai tilpumu:
1) fosfors - 4 moli jeb 124 g;
2) fosfora (V) oksīds - 2 mol, 284 g;
3) skābeklis - 5 moli jeb 160 litri.
Tālāk esošais kalkulators ir paredzēts ķīmisko reakciju izlīdzināšanai.
Kā zināms, ķīmisko reakciju izlīdzināšanai ir vairākas metodes:
- Koeficientu izvēles metode
- matemātiskā metode
- Garsijas metode
- Elektroniskā bilances metode
- Elektronu jonu līdzsvara metode (pusreakcijas metode)
Pēdējie divi tiek izmantoti redoksreakcijām.
Šis kalkulators izmanto matemātiskā metode- parasti sarežģītu ķīmisko vienādojumu gadījumā manuāli aprēķini ir diezgan darbietilpīgi, taču tas darbojas lieliski, ja dators visu aprēķina jūsu vietā.
Matemātiskās metodes pamatā ir masas nezūdamības likums. Masas nezūdamības likums nosaka, ka katra elementa vielas daudzums pirms reakcijas ir vienāds ar katra elementa vielas daudzumu pēc reakcijas. Tādējādi ķīmiskā vienādojuma kreisajā un labajā pusē ir jābūt vienādam viena vai otra elementa atomu skaitam. Tas ļauj līdzsvarot jebkuru reakciju vienādojumus (ieskaitot redoksreakciju). Lai to izdarītu, ierakstiet reakcijas vienādojumu vispārējs skats, pamatojoties uz materiālu bilanci (noteiktas masas vienlīdzību ķīmiskais elements sākuma un iegūtajās vielās) sastādīt matemātisko vienādojumu sistēmu un atrisināt to.
Apskatīsim šo metodi ar piemēru:
Norāda ķīmisko reakciju:
Apzīmē nezināmos koeficientus:
Sastādām vienādojumus katra ķīmiskajā reakcijā iesaistītā elementa atomu skaitam:
Fe:
Cl:
Na:
P:
O:
Mēs tos rakstām vispārīgas sistēmas veidā:
Šajā gadījumā mums ir pieci vienādojumi četriem nezināmajiem, un piekto var iegūt, reizinot ceturto ar četriem, lai to varētu droši izmest.
Pārrakstīsim šo lineāro sistēmu algebriskie vienādojumi matricas formā:
Šo sistēmu var atrisināt ar Gausa metodi. Patiesībā ne vienmēr būs tik paveicies, ka vienādojumu skaits sakritīs ar nezināmo skaitu. Tomēr Gausa metodes skaistums ir tāds, ka tā vienkārši ļauj atrisināt sistēmas ar jebkādu vienādojumu un nezināmo skaitu. Īpaši šim nolūkam tika uzrakstīts kalkulators Lineāro vienādojumu sistēmas atrisināšana ar Gausa metodi ar vispārīga risinājuma atrašanu, ko izmanto ķīmisko reakciju izlīdzināšanā.
Tas ir, zemāk esošais kalkulators parsē reakcijas formulu, apkopo SLAE un nosūta to kalkulatoram no iepriekš esošās saites, kas atrisina SLAE, izmantojot Gausa metodi. Pēc tam risinājumu izmanto, lai parādītu līdzsvarotu vienādojumu.
Ķīmiskie elementi jāraksta tā, kā tie ir rakstīti periodiskajā tabulā, t.i., jāņem vērā lielie un mazie burti (Na3PO4 - pareizi, na3po4 - nepareizi).