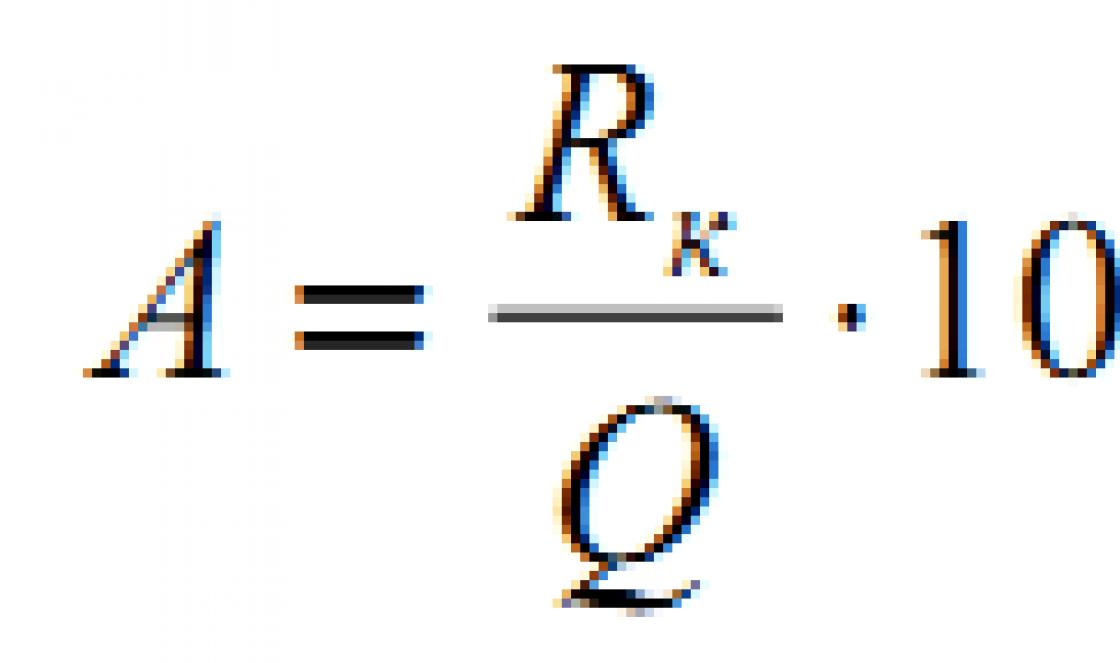MÄÄRATLUS
Neoon- inertsete (vääris)gaaside klassi kuuluv keemiline element. Asub alagrupi VIII rühma A teisel perioodil, kui vaadata lühikese perioodi tabelit, või 18. grupis, kui vaadata pika perioodi tabelit.
Seerianumber on 10. Tuumalaeng on +10. Aatommass - 20,179 amu.
Neoonaatomi elektrooniline struktuur
Neoonaatom koosneb positiivselt laetud tuumast (+10), mille ümber liigub aatomikestates (orbitaalides) 10 elektroni. Kuna neoon asub teises perioodis, on neid kestasid kaks. Heeliumi aatomi struktuur on näidatud joonisel 1:
Riis. 1. Neoonaatomi ehitus.
Neoonaatomi elektroonilist konfiguratsiooni saab kirjutada kahel viisil:
1s 2 2s 2 2p 6 .
Neoon kuulub p-elementide perekonda. Neoonaatomi energiadiagramm näeb välja selline:

Neoonaatomi energiatase on täielik, kuna p-orbitaal mahutab ainult kuus elektroni. Seetõttu klassifitseeritakse neoon inertseks gaasiks. Keemiliselt on see inaktiivne.
Näited probleemide lahendamisest
NÄIDE 1
/mol)
(esimene elektron)
(Paulingi järgi)
| Ne | 10 |
| 20,1797 | |
| 2s 2 2p 6 | |
| Neoon | |
Neoon- kaheksanda rühma põhialarühma element, D.I.Mendelejevi keemiliste elementide perioodilise süsteemi teine periood, aatomnumbriga 10. Tähistatakse sümboliga Ne (Neoon). Universumi arvukuse poolest viies element (vesiniku, heeliumi, hapniku ja süsiniku järel). Lihtne aine neoon (CAS number: 7440-01-9) on inertne üheaatomiline gaas, millel pole värvi, maitset ega lõhna.
Neooni avastasid juunis 1898 Šoti keemik William Ramsay ja inglise keemik Maurice Travers. Nad eraldasid selle inertgaasi "välistusmeetodiga" pärast seda, kui hapnik, lämmastik ja kõik õhu raskemad komponendid olid veeldatud. Elemendile anti lihtne nimi "neoon", mis kreeka keelest tõlgituna tähendab "uus". Detsembris 1910 valmistas prantsuse leiutaja Georges Claude neooniga täidetud gaaslahenduslambi.
nime päritolu
Nimi pärineb kreeka keelest. νέος - uus.
On legend, mille kohaselt andis elemendile nime Ramsay 13-aastane poeg Willie, kes küsis isalt, kuidas ta kavatseb uut gaasi nimetada, märkides, et ta soovib sellele nime anda. novum(Lat. – uus). Tema isale see idee meeldis, kuid ta tundis seda pealkirjana neoon, mis tuleneb kreekakeelsest sünonüümist, kõlab paremini.
Laotamine
Maailma aines on neoon jaotunud ebaühtlaselt, kuid üldiselt on ta Universumis levimuse poolest kõigi elementide seas viiendal kohal – umbes 0,13 massiprotsenti. Suurimat neooni kontsentratsiooni täheldatakse Päikesel ja teistel kuumadel tähtedel, gaasiudukogudes ja välisplaneetide atmosfääris Päikesesüsteem- Jupiter, Saturn, Uraan, Neptuun. Paljude tähtede atmosfääris on neoon vesiniku ja heeliumi järel kolmandal kohal.
Maakoor
Kõigist teise perioodi elementidest neoon- väikseim rahvaarv Maal. Kaheksanda rühma sees neoon sisu järgi maakoor on argooni ja heeliumi järel kolmandal kohal. Gaasiudud ja mõned tähed sisaldavad kordades rohkem neooni, kui Maal leidub.
Maal on kõrgeim neooni kontsentratsioon atmosfääris - 1,82 10–3% mahust ja selle koguvarud on hinnanguliselt 7,8 10 14 m³. 1 m³ õhku sisaldab umbes 18,2 cm³ neooni (võrdluseks: sama õhuhulk sisaldab ainult 5,2 cm³ heeliumi). Keskmine neoonisisaldus maakoores on madal – 7·10−9 massiprotsenti. Kokku on meie planeedil umbes 6,6 10 10 tonni neooni. Tardkivimid sisaldavad seda elementi umbes 10 9 tonni. Kivide lagunemisel pääseb gaas atmosfääri. Vähemal määral on atmosfäär varustatud neoon- ja looduslike vetega.
Teadlased näevad meie planeedi neoonvaesuse põhjust selles, et Maa kaotas kunagi oma esmase atmosfääri, mis võttis endaga kaasa suurema osa inertgaasidest, mis ei suutnud sarnaselt hapniku ja muude gaasidega keemiliselt siduda teiste elementidega mineraale ja mineraale. seeläbi planeedil kanda kinnitada.
Definitsioon
Neoon määratakse kvalitatiivselt emissioonispektritega (karakteristikud 585,25 nm ja 540,05 nm), kvantitatiivselt massispektromeetriliste ja kromatograafiliste analüüsimeetoditega.
Füüsikalised omadused
- Väärisgaasid on värvitud üheaatomilised gaasid, millel pole värvi ega lõhna.
- Inertgaasidel on teiste gaasidega võrreldes kõrgem elektrijuhtivus ja voolu läbimisel helendavad nad eredalt, eriti tulipunase valgusega neoon, kuna selle eredaimad jooned asuvad spektri punases osas.
Neoonkiirguse spekter (vasakult paremale: ultraviolett-infrapuna jooned on näidatud valgelt)
- Inertgaaside aatommolekulide küllastunud olemus väljendub ka selles, et inertgaasidel on madalam veeldumis- ja külmumistemperatuur kui teistel sama molekulmassiga gaasidel.
Keemilised omadused
Kõikidel väärisgaasidel on täielik elektronkiht, seega on nad keemiliselt inertsed. Keemiline inertsus mitte tema on erakordne, ainult heelium suudab sellega võistelda. Siiani pole saadud ühtegi valentsühendit. Isegi neooni nn klatraatühendeid vee (Ne 6H 2 O), hüdrokinooni ja teiste ainetega (raskete väärisgaaside sarnased ühendid – radoon, ksenoon, krüptoon ja isegi argoon – on laialt tuntud) on väga raske hankida ja säilitada. .
Maa peal domineeriva kerge nukliidi 20 Ne allikat pole veel kindlaks tehtud.
Arvatakse, et avakosmoses esindab neooni valdavalt ka valgusnukliid 20 Ne. Meteoriitides leidub palju 21 Ne ja 22 Ne, kuid arvatavasti tekivad need nukliidid meteoriitides endas mõjul kosmilised kiired universumis reisimise ajal.
Lisaks kolmele stabiilsele neoonnukliidile on veel kuusteist ebastabiilset.
Kviitung
Neoon saadakse koos heeliumiga õhu veeldamise ja eraldamise protsessi kõrvalsaadusena. Heeliumi eraldamine ja mitte tema toimub adsorptsiooni ja kondenseerumise tõttu. Adsorptsioonimeetod põhineb võimel mitte tema erinevalt heeliumist on see adsorbeeritud (Ne + He sisaldus kuni 70%); gaasisegu ekstraheerimisaste on 0,5-0,6. Lõplik puhastamine N2-st ning Ne ja He eraldamine võib toimuda kas selektiivse adsorptsiooniga vedela N2 temperatuuril või kondensatsioonimeetoditega – kasutades vedelat N2 või. Varem kasutati neooni tööstuses inertse keskkonnana, kuid see asendati odavama argooniga.
Neoontorudest valmistatud elemendi sümbol
Neooni kasutatakse gaaslahenduslampide, raadioseadmete signaallampide, fotoelementide ja alaldite täitmiseks.
Kasutatakse neooni ja heeliumi segu töökeskkond gaasilaserites (heelium-neoonlaser).
Neooni ja lämmastiku seguga täidetud torud annavad elektrilahenduse läbimisel punakasoranži kuma ja seetõttu kasutatakse neid laialdaselt reklaamides.
Neoonlampe kasutatakse signalisatsiooniks tuletornides ja lennuväljadel, kuna nende punast värvi hajutab udu ja udu väga vähe.
Bioloogiline roll
Neoon ei mängi mingit bioloogilist rolli.
Füsioloogiline toime
Inertgaasidel on füsioloogiline toime, mis väljendub nende narkootilises toimes organismile. Neooni (nagu ka heeliumi) narkootilist toimet normaalrõhul katsetes ei registreerita, samas kui kõrge rõhu korral ilmnevad "kõrgsurve närvisündroomi" (HBP) sümptomid varem.
Sellega seoses kasutavad okeanautid, sukeldujad ja kõrge rõhu all töötavad inimesed hingamiseks koos heeliumiga neooni ja heeliumi segu osana neooni, et vältida gaasiembooliat ja lämmastiknarkoosi. Segu eeliseks on see, et see jahutab keha vähem, kuna neooni soojusjuhtivus on väiksem kui heeliumil.
Kerge neoonheeliumõhk leevendab ka hingamishäirete all kannatavate patsientide seisundit.
"Neoontuled" vastavad oma nimele ainult siis, kui nad helendavad punaselt. Muude värvide saamiseks kasutatakse elavhõbedat ja fosforit teatud vahekorras või muid väärisgaase.
Neoon, neoon, neoon (10)
Keemiline element neoon avastasid Ramsay ja Travers 1898. aastal, paar päeva pärast krüptooni avastamist. Teadlased võtsid proovid esimestest vedela argooni aurustumisel tekkivatest gaasimullidest ja avastasid, et selle gaasi spekter näitab uue elemendi olemasolu. Ramsay räägib sellele elemendile nime valimisest: "Kui me esimest korda selle spektrit vaatasime, oli seal minu 12-aastane poeg."
Isa, ütles ta, mis selle nimi on ilus gaas?
"See pole veel otsustatud," vastasin.
Kas ta on uus? - küsis poeg uudishimulikult.
Äsja avastatud- vaidlesin vastu.
Miks mitte sel juhul helistada Novum, isa?
See ei sobi, sest novum"Mitte ühtegi kreeka sõna," vastasin.
Me nimetame seda neooniks, mis kreeka keeles tähendab uut, millest sai gaas oma nime.
Kõigi elementide hulgas keemiline tabel Mendelejevi sõnul on sellisel rühmal nagu inertgaasid huvitavad omadused. Nende hulka kuuluvad argoon, neoon, heelium ja mõned muud ained. Mis on neoon ja kus see on kaasaegne maailm Kas seda gaasi kasutatakse laialdaselt?
Neooni avastamise ajalugu
Perioodilisustabelit ei täitnud kõik kohe keemilised elemendid, nii et mõnes rühmas ja perioodis esines lünki. Seega ennustasid keemikud uute ainete avastamist, mis juhtus ka neooniga. Esimene teadlane, kes neooni olemasolule mõtles, oli keemik Ramsay Rayleigh. Sel ajal avastati kaks lähimat inertgaasi: argoon ja heelium, kuid tabeli vahelahter oli tühi. Teadlane oletas, et uue elemendi aatommass on 20 ja vesiniku tihedus 10, kuid seda, milline on neoon looduses, polnud teada.
Kuidas suutis Ramsay neooni isoleerida ja selle olemasolu tõestada? Tema katses kasutati tavalist, mis esmalt veeldati ja seejärel aeglaselt aurustati. Nii saadud gaasilisi fraktsioone uuriti väljalasketorus, mis võimaldas näha ainete spektrijooni. Sellega seoses leidsid nad uue elemendi.
Universumis on kuues levinuim element neoon. Sõna tähendus kreeka keelest tõlgitakse kui "uus". Algselt soovitas Ramsay poeg Willie uut elementi nimetada novumiks, mis tähendas ka "uut", kuid isa otsustas sõna veidi muuta neooniks, mis tema arvates kõlas paremini.
Neooni omadused
See inertgaas asub perioodilisustabelis argooni ja heeliumi vahel, mis annab talle nende ainete vahepealsed omadused. Neoonil on kaks energiataset, 2 ja 8 elektroniga. See omadus mõjutab otseselt gaasi reaktsioonivõimet, kuna see ei moodusta ühendeid teiste elementidega.

Mis on neoon keemilisest vaatenurgast? See on kerge gaas, mis veeldub temperatuuril -245,98 °C ja keemistemperatuur on 2,6 °C. Gaasi lahustuvus vees on väga madal, kuid neooni adsorptsioon aktiivsöel võimaldab eraldada puhast gaasi selle lisanditest.
Mis on neoon füüsika seisukohast? See on gaas, mis voolu mõjul jaguneb helepunaseks ja oranžiks spektriks. mida see samal ajal kiirgab, on väga stabiilne ja särav. Selle nähtuse füüsika seisneb selles, et elektronid löövad neoonaatomeid, põhjustades nende valguse footonite vabastamist.
Kus on neoon
Universumis on neoon heeliumi, vesiniku ja paljude teiste elementide järel 6. kohal. See inertgaas hõivab suhteliselt suures koguses tähti ja punaseid planeete. Pluutot uurides pakuti välja, et selle atmosfäär koosneb täielikult neoonist ja alumistes kihtides see gaas veeldub selle planeedi kriitiliselt madalate temperatuuride tõttu.

Mis puutub Maasse, siis kõige rohkem leidub neooni atmosfääris (0,00182%) ja väga vähe maakoores. Arvatakse, et väärisgaaside võimetus seostuda teiste elementidega ja moodustada mineraale oli peamine põhjus, miks neid aineid väikeses koguses Maale jäi.
Neooni kasutamine
Tänapäeval on nõudlus neooni järele tootmises kõvasti kasvanud, mis tähendab pidevat puudust. See on tingitud asjaolust, et puhta inertgaasi vabanemine võtab üsna kaua aega ja selle sisaldus õhus on väga madal.
Neooni kasutatakse tööstuses krüogeentehnoloogia jahutusvedelikuna. Raketikütust hoitakse vedelal neoontemperatuuril, loomade ja taimede kuded külmutatakse, keemilised ained. Neoonkristallides luuakse optimaalsed tingimused väga keeruliste reaktsioonide toimumiseks, mis ei talu kuumust (H2O2 süntees, hapnikufluoriidid jne).
Mõned lambid ja valgustid kasutavad ka neooni. Selle gaasi tähtsus valgusallikana on väga suur, sest selle sära on näha pikkade vahemaade tagant. kasutatakse paigaldamiseks tuletornidele, lennuvälja ribadele, kõrghoonetele. Osa tekstreklaame on valgustatud neoonlampidega.

Sellistes lampides ei ole neoon puhtal kujul. See on alati segatud õiges vahekorras argooniga, mis annab valgusele oranži värvi. See aga ei halvenda kuidagi hea nähtavuse omadusi, sest Sellised lambid on nähtavad mis tahes ebasoodsates ilmastikutingimustes ja pikkade vahemaade tagant.
MÄÄRATLUS
Neoon- kümnes element perioodilisustabel. Nimetus - Ne ladinakeelsest sõnast "neoon". Asub teisel perioodil, VIIIA rühm. Kuulub inertsete (vääris)gaaside rühma. Tuumalaeng on 10.
Neoon on värvitu, raskesti veeldatav gaas. Neoonisisaldus õhus on 0,0015% (maht). See on vees praktiliselt lahustumatu ja etanoolis halvasti lahustuv. Moodustab klatraadi koostisega 8Ne×46H 2 O. Keemiliselt inertne, ei reageeri kõigi teiste ainetega (lihtne ja kompleksne).
Neooni aatom- ja molekulmass
Suhteline molekulmass M r on molekuli molaarmass jagatud 1/12-ga molaarmass süsinik-12 aatomit (12 C). See on mõõtmeteta suurus.
Sugulane aatommass A r on aine aatomi molaarmass jagatud 1/12 süsiniku-12 aatomi molaarmassist (12 C).
Kuna vabas olekus eksisteerib neoon monatoomiliste Ne molekulide kujul, langevad selle aatom- ja molekulmassi väärtused kokku. Need on võrdsed 20,1797-ga.
Neooni isotoobid
Neooni võib leida kolmes isotoobis: 20 Ne (90,48%), 21 Ne (0,27%) ja 22 Ne (9,25%). Nende massinumbrid on vastavalt 20, 21 ja 22. Neooni isotoobi 20 Ne aatomi tuum sisaldab kümmet prootonit ja kümme neutronit ning isotoobid 21 Ne ja 22 Ne sisaldavad sama palju prootoneid, vastavalt üksteist ja kaksteist neutronit.
Samuti on kuusteist neooni ebastabiilset isotoopi.
Neooniioonid
Nagu heelium, moodustab neoon aatomite tugeva ergastusega Ne 2 + tüüpi molekulaarseid ioone:
σ s 2 σ s * σ z 2 π 4 x,y π *4 x,y σ z *1.
Neoonmolekul ja aatom
Vabas olekus eksisteerib neoon monatoomiliste Ne molekulide kujul.
Näited probleemide lahendamisest
NÄIDE 1
Pakume gaasilist ja vedelat neooni (Ne) laias kontsentratsiooni ja puhtuse vahemikus. Palun vaadake Praxair Pure Neoni ohutuskaarti.
Lisaks loetletud toodetele valmistame spetsiaalseid segusid, mis sisaldavad kindlaksmääratud komponente kuni ppm ja ppb. Valmistame neooni segusid teiste inertgaasidega, samuti halogeenidega, tuleohtlike ja mürgiste ainetega. Helistage meile ja aitame teil saavutada maksimaalset kasu neooni kasutamisest oma tootmises.
Neoon on gaasisegude oluline komponent eksimerlaserid- selliseid segusid kasutatakse ülitäpsete laserkiirte loomiseks optilises litograafias ja polüräni õhukeste kilede lõõmutamiseks kontrollitud atmosfääris pooljuhtide ja lameekraanide tootmisel.
Tarnime neooni kõrgsurve teras- ja alumiiniumballoonides (kuni 200 atm) erineva mahuga (25 kuni 10 000 liitrit). Tootmisettevõtetele, mis vajavad vedelal kujul neooni, pakume toodet 250-liitristes Dewari kolbides.
Kas te pole otsustanud, milline variant on parem?
Praxairi tootmismastaap ja ulatuslik jaotusvõrk võimaldavad meil tarnida mis tahes gaase mis tahes rakenduste jaoks peaaegu kõikjale planeedil – ohutult, usaldusväärselt ja optimaalsete kuludega. Võtke meiega ühendust ja aitame teil valida teie toodangule parima tarnevõimaluse.