Ռեակցիաների առաջին խումբը փոխարինման ռեակցիաներն են։ Մենք ասացինք, որ արենները մոլեկուլային կառուցվածքում չունեն բազմաթիվ կապեր, այլ պարունակում են վեց էլեկտրոններից կազմված խոնարհված համակարգ, որը շատ կայուն է և լրացուցիչ ամրություն է հաղորդում բենզոլային օղակին։ Հետևաբար, մեջ քիմիական ռեակցիաներսկզբում տեղի է ունենում ջրածնի ատոմների փոխարինումը, այլ ոչ թե բենզոլի օղակի ոչնչացումը։
Ալկանների մասին խոսելիս արդեն հանդիպել ենք փոխարինման ռեակցիաների, սակայն նրանց համար այդ ռեակցիաներն ընթացել են արմատական մեխանիզմով, իսկ արենների համար դա բնորոշ է. իոնային մեխանիզմփոխարինման ռեակցիաներ.
Առաջինքիմիական հատկությունների հալոգենացում. Ջրածնի ատոմի փոխարինում հալոգենի ատոմով քլորով կամ բրոմով:
Ռեակցիան ընթանում է տաքացման ժամանակ և միշտ կատալիզատորի մասնակցությամբ։ Քլորի դեպքում դա կարող է լինել ալյումինի քլորիդ կամ երկաթի քլորիդ երեք: Կատալիզատորը բևեռացնում է հալոգենի մոլեկուլը, որի արդյունքում հետերոլիտիկ կապը կոտրվում է և ստացվում են իոններ։
Դրական լիցքավորված քլորիդ իոնը փոխազդում է բենզոլի հետ։
Եթե ռեակցիան տեղի է ունենում բրոմի հետ, ապա երկաթի բրոմիդ երեքը կամ ալյումինի բրոմիդը գործում են որպես կատալիզատոր:

Կարևոր է նշել, որ ռեակցիան տեղի է ունենում մոլեկուլային բրոմի և ոչ թե բրոմ ջրի հետ: Բենզոլը չի արձագանքում բրոմ ջրի հետ:
Բենզոլի հոմոլոգների հալոգենացումը ունի իր առանձնահատկությունները: Տոլուոլի մոլեկուլում մեթիլ խումբը հեշտացնում է փոխարինումը օղակում, ռեակտիվությունը մեծանում է, և ռեակցիան ընթանում է ավելի մեղմ պայմաններում, այսինքն՝ արդեն սենյակային ջերմաստիճանում։

Կարևոր է նշել, որ փոխարինումը միշտ տեղի է ունենում օրթո և պարա դիրքերում, ուստի ստացվում է իզոմերների խառնուրդ։
Երկրորդբենզոլի սեփականության նիտրացում, նիտրո խմբի ներմուծում բենզոլային օղակ:

Ձևավորվում է դառը նուշի նիտրոբենզոլի հոտով թանձր դեղնավուն հեղուկ, ուստի ռեակցիան կարող է որակական լինել բենզոլի համար։ Նիտրացիայի համար օգտագործվում է խտացված ազոտական և ծծմբական թթուների նիտրացնող խառնուրդ։ Ռեակցիան իրականացվում է տաքացման միջոցով։
Հիշեցնեմ, որ Կոնովալովի ռեակցիայում ալկանների նիտրացման համար նոսրացրեք Ազոտական թթուառանց ծծմբի ավելացման:
Տոլուոլի նիտրացման, ինչպես նաև հալոգենացման ժամանակ առաջանում է օրթո– և պարաիզոմերների խառնուրդ։

Երրորդբենզոլի հատկության ալկիլացում հալոալկաններով.

Այս ռեակցիան թույլ է տալիս ածխաջրածնային ռադիկալ ներմուծել բենզոլային օղակ և կարելի է համարել բենզոլի հոմոլոգներ ստանալու մեթոդ։ Որպես կատալիզատոր օգտագործվում է ալյումինի քլորիդը, որը նպաստում է հալոալկանի մոլեկուլի իոնների քայքայմանը։ Ունի նաև ջեռուցման կարիք։
Չորրորդբենզոլի հատկության ալկիլացում ալկեններով.

Այս կերպ, օրինակ, կարելի է ստանալ կումեն կամ էթիլբենզոլ։ Կատալիզատոր ալյումինի քլորիդ:
2. Բենզոլին ավելացման ռեակցիաներ
Ռեակցիաների երկրորդ խումբը հավելման ռեակցիաներն են։ Մենք ասացինք, որ այդ ռեակցիաները բնորոշ չեն, բայց դրանք հնարավոր են բավականին կոշտ պայմաններում պի-էլեկտրոնային ամպի ոչնչացման և վեց սիգմա կապերի ձևավորման դեպքում։
Հինգերորդհատկություն ընդհանուր ցանկում ջրածինացում, ջրածնի ավելացում։
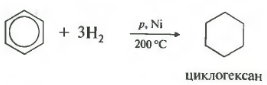
Ջերմաստիճան, ճնշում, կատալիզատոր նիկել կամ պլատին: Տոլուենը կարողանում է նույն կերպ արձագանքել։
վեցերորդգույքի քլորացում. Խնդրում ենք նկատի ունենալ, որ մենք կոնկրետ խոսում ենք քլորի հետ փոխազդեցության մասին, քանի որ բրոմը չի մտնում այս ռեակցիայի մեջ:

Ռեակցիան ընթանում է կոշտ ուլտրամանուշակագույն ճառագայթման տակ։ Առաջանում է հեքսաքլորցիկլոհեքսան՝ հեքսաքլորանի մեկ այլ անվանում՝ պինդ։
Կարևոր է հիշել, որ բենզոլի համար անհնարջրածնի հալոգենիդների ավելացման ռեակցիաներ (հիդրոհալոգենացում) և ջրի ավելացում (հիդրացիա):
3. Բենզոլի հոմոլոգների կողային շղթայում փոխարինում
Ռեակցիաների երրորդ խումբը վերաբերում է միայն բենզոլային հոմոլոգներին. սա փոխարինում է կողային շղթայում:
յոթերորդհատկություն ընդհանուր ցանկում հալոգենացում ածխածնի ալֆա ատոմում կողային շղթայում:

Ռեակցիան տեղի է ունենում տաքացման կամ ճառագայթման ժամանակ և միշտ միայն ալֆա ածխածնի վրա: Քանի որ հալոգենացումը շարունակվում է, երկրորդ հալոգենի ատոմը կվերադառնա ալֆա դիրքի:
4. Բենզոլի հոմոլոգների օքսիդացում
Ռեակցիաների չորրորդ խումբը օքսիդացումն է։
Բենզոլի օղակը չափազանց ամուր է, ուստի բենզոլ չի օքսիդանումկալիումի պերմանգանատը չի գունաթափում իր լուծույթը: Սա շատ կարևոր է հիշել:
Մյուս կողմից, բենզոլի հոմոլոգները տաքացնելիս օքսիդացվում են կալիումի պերմանգանատի թթվացված լուծույթով։ Եվ սա ութերորդ քիմիական հատկությունն է։

Ստացվում է բենզոաթթու։ Նկատվում է լուծույթի գունաթափում։ Այս դեպքում, անկախ նրանից, թե որքան երկար է փոխարինողի ածխածնային շղթան, այն միշտ կոտրվում է առաջին ածխածնի ատոմից հետո և ալֆա ատոմը օքսիդացվում է կարբոքսիլային խմբի՝ բենզոաթթվի ձևավորմամբ։ Մոլեկուլի մնացած մասը օքսիդացվում է համապատասխան թթուով կամ, եթե դա ընդամենը մեկ ածխածնի ատոմ է, ածխաթթու:
Եթե բենզոլի հոմոլոգն ունի մեկից ավելի ածխաջրածնային փոխարինիչներ արոմատիկ օղակի վրա, ապա օքսիդացումը տեղի է ունենում նույն կանոններով՝ ալֆա դիրքում գտնվող ածխածինը օքսիդացված է։

Այս օրինակում ստացվում է երկհիմնական անուշաբույր թթու, որը կոչվում է ֆտալաթթու։
Հատուկ կերպով նշում եմ կումենի՝ իզոպրոպիլբենզոլի օքսիդացումը մթնոլորտի թթվածնով ծծմբաթթվի առկայության դեպքում։

Սա ֆենոլի արտադրության այսպես կոչված կումենի մեթոդն է։ Որպես կանոն, այս ռեակցիայի հետ պետք է զբաղվել ֆենոլի արտադրության հետ կապված հարցերում։ Սա արդյունաբերական ճանապարհն է։
իններորդգույքի այրում, ամբողջական օքսիդացում թթվածնով։ Բենզոլը և նրա հոմոլոգները այրվում են մինչև ածխաթթու գազ և ջուր:
Եկեք գրենք բենզոլի այրման հավասարումը ընդհանուր ձևով:
Ըստ զանգվածի պահպանման օրենքի՝ ձախ կողմում պետք է լինի այնքան ատոմ, որքան աջ կողմում։ Որովհետև, ի վերջո, քիմիական ռեակցիաներում ատոմները ոչ մի տեղ չեն գնում, այլ ուղղակի փոխվում է նրանց միջև կապերի կարգը։ Այսպիսով, կլինեն այնքան ածխածնի երկօքսիդի մոլեկուլներ, որքան ածխածնի ատոմներ կան արենի մոլեկուլում, քանի որ մոլեկուլը պարունակում է մեկ ածխածնի ատոմ: Դա n CO 2 մոլեկուլ է: Կլինեն ջրի մոլեկուլների կեսը, որքան ջրածնի ատոմները, այսինքն՝ (2n-6) / 2, ինչը նշանակում է n-3:
Ձախ և աջ կողմում կան նույն թվով թթվածնի ատոմներ: Աջ կողմում կա 2n ածխաթթու գազից, քանի որ յուրաքանչյուր մոլեկուլում կա երկու թթվածնի ատոմ, գումարած n-3 ջրից, ընդհանուր առմամբ 3n-3: Ձախ կողմում կան նույն թվով թթվածնի ատոմներ 3n-3, ինչը նշանակում է, որ մոլեկուլները երկու անգամ ավելի քիչ են, քանի որ մոլեկուլը պարունակում է երկու ատոմ։ Այսինքն (3n-3)/2 թթվածնի մոլեկուլ։
Այսպիսով, մենք կազմել ենք բենզոլի հոմոլոգների այրման հավասարումը ընդհանուր ձևով:
Արենները անուշաբույր ածխաջրածիններ են, որոնք պարունակում են մեկ կամ մի քանի բենզոլային օղակներ։ Բենզոլի օղակը կազմված է 6 ածխածնի ատոմներից, որոնց միջև կրկնակի և մեկ կապերը հերթափոխ են լինում։
Կարևոր է նշել, որ բենզոլի մոլեկուլում կրկնակի կապերը ֆիքսված չեն, այլ անընդհատ շարժվում են շրջանագծի մեջ։
Արենները կոչվում են նաև արոմատիկ ածխաջրածիններ։ Հոմոլոգ շարքի առաջին անդամը բենզոլն է՝ C 6 H 6: Նրանց հոմոլոգ շարքի ընդհանուր բանաձևը C n H 2n-6 է:
Երկար ժամանակով կառուցվածքային բանաձեւբենզոլը մնաց առեղծված: Երկու եռակի կապերով Կեկուլեի առաջարկած բանաձևը չէր կարող բացատրել այն փաստը, որ բենզինը չի մտնում ավելացման ռեակցիաների մեջ։ Ինչպես նշվեց վերևում, ժամանակակից հասկացությունների համաձայն, մոլեկուլում կրկնակի կապերը անընդհատ շարժվում են, ուստի ավելի ճիշտ է դրանք գծել օղակի տեսքով:
Կրկնակի կապերը բենզոլի մոլեկուլում ստեղծում են կոնյուգացիա։ Ածխածնի բոլոր ատոմները գտնվում են sp 2 հիբրիդացման վիճակում։ Վալենտային անկյուն - 120°:
Արենների նոմենկլատուրա և իզոմերիզմ
Արենների անվանումները ձևավորվում են հիմնական շղթային՝ բենզոլային օղակին փոխարինողների անուններ ավելացնելով՝ բենզոլ, մեթիլբենզոլ (տոլուոլ), էթիլբենզոլ, պրոպիլբենզոլ և այլն։ Փոխարինիչները, ինչպես միշտ, թվարկված են այբբենական կարգով: Եթե բենզոլային օղակում կան մի քանի փոխարինիչներ, ապա նրանց միջև ընտրվում է ամենակարճ ճանապարհը։

Արեններին բնորոշ է կառուցվածքային իզոմերիզմը՝ կապված փոխարինողների դիրքի հետ։ Օրինակ, բենզոլային օղակի վրա երկու փոխարինող կարող է լինել տարբեր դիրքերում:
Բենզոլային օղակում փոխարինողների դիրքի անվանումը ձևավորվում է ելնելով միմյանց նկատմամբ նրանց գտնվելու վայրից: Այն նշվում է ortho-, meta- և para նախածանցներով: Ստորև դուք կգտնեք մնեմոնիկ ակնարկներ դրանց հաջող մտապահման համար;)

Արենաներ ստանալը
Արենաները ձեռք են բերվում մի քանի եղանակով.

Արենների քիմիական հատկությունները
Արենները անուշաբույր ածխաջրածիններ են, որոնք պարունակում են բենզոլային օղակ՝ խոնարհված կրկնակի կապերով։ Այս հատկությունը բարդացնում է ավելացման ռեակցիաները (բայց դեռ հնարավոր է!)
Հիշեք, որ, ի տարբերություն այլ չհագեցած միացությունների, բենզոլը և նրա հոմոլոգները չեն գունաթափում բրոմ ջուրը և կալիումի պերմանգանատի լուծույթը:

© Բելևիչ Յուրի Սերգեևիչ 2018-2020 թթ
Այս հոդվածը գրվել է Յուրի Սերգեևիչ Բելևիչի կողմից և նրա մտավոր սեփականությունն է։ Պատճենելը, տարածելը (այդ թվում՝ պատճենելով այլ կայքեր և ռեսուրսներ ինտերնետում) կամ տեղեկատվության և առարկաների ցանկացած այլ օգտագործում՝ առանց հեղինակային իրավունքի սեփականատիրոջ նախնական համաձայնության, պատժվում է օրենքով: Հոդվածի նյութերը ձեռք բերելու և դրանք օգտագործելու թույլտվություն ստանալու համար խնդրում ենք դիմել
   |
|
| Համակարգային Անուն | բենզոլ |
| հապավումներ | PhH |
| Ավանդական անուններ | վարսահարդարիչ (Laurent, 1837), ֆենիլ ջրածին, բենզոլ |
| Քիմ. բանաձեւը | C₆H₆ |
| Պետություն | հեղուկ |
| Մոլային զանգված | 78.11 գ/մոլ |
| Խտություն | 0,8786 գ/սմ³ |
| Դինամիկ մածուցիկություն | 0,0652 Պա ս |
| Իոնացման էներգիա | 9,24 ± 0,01 էՎ |
| T. հալվել. | 5,5° |
| T. kip. | 80,1° |
| T. rev. | −11° |
| T. svsp. | 562° |
| և այլն: պայթյուն | 1.2 ± 0.1 vol% |
| Գոլորշի ճնշում | 75 ± 1 մմ Hg |
| Լուծելիություն ջրի մեջ | 0,073 գ/100 մլ |
| ԳՕՍՏ | ԳՕՍՏ 5955-75 |
| կանոն. CAS համարը | 71-43-2 |
| PubChem | 241 |
| կանոն. EINECS համարը | 200-753-7 |
| ԺՊԻՏՆԵՐ | C1=CC=CC=C1 |
| InChI | |
| RTECS | CY1400000 |
| ՉԵԲԻ | 16716 |
| ChemSpider | 236 |
| Թունավորություն | թունավոր է, ունի քաղցկեղածին և թմրադեղային հատկություններ |
| ազդանշանային բառ | ՎՏԱՆԳԱՎՈՐ! |
| Տվյալները տրվում են ստանդարտ պայմանների համար (25°, 100 կՊա), եթե այլ բան նշված չէ: | |
Քիմիական հատկություններ
Բենզոլին բնորոշ են փոխարինման ռեակցիաները՝ բենզոլը փոխազդում է ալկենների, քլորալկանների, հալոգենների, ազոտական և ծծմբական թթուների հետ։ Բենզոլի օղակի ճեղքման ռեակցիաները տեղի են ունենում ծանր պայմաններում (ջերմաստիճան, ճնշում):
- Ալկենների հետ փոխազդեցություն (ալկիլացում), ռեակցիայի արդյունքում ձևավորվում են բենզոլային հոմոլոգներ, օրինակ՝ էթիլբենզոլ և կումեն.
- Քլորի և բրոմի հետ փոխազդեցությունը կատալիզատորի առկայության դեպքում քլորբենզոլ ձևավորելու համար (էլեկտրոֆիլ փոխարինման ռեակցիա).
- Կատալիզատորի բացակայության դեպքում, երբ տաքացվում կամ վառվում է, արմատական ռեակցիահավելում` հեքսաքլորցիկլոհեքսանի իզոմերների խառնուրդ առաջացնելու համար
- Երբ բենզոլը օլեումի լուծույթում փոխազդում է բրոմի հետ, առաջանում է հեքսաբրոմոբենզոլ.
- Ալկանների հալոգեն ածանցյալների հետ փոխազդեցություն (բենզոլի ալկիլացում, Ֆրիդել-Կրաֆթսի ռեակցիա) ալկիլբենզոլներ ձևավորելու համար.

- Բենզոլի անհիդրիդների, կարբոքսիլաթթվի հալոգենիդների Friedel-Crafts ացիլացման ռեակցիան հանգեցնում է անուշաբույր և ճարպային արոմատիկ կետոնների ձևավորմանը.

6 6 + 6 5 COCl → AlCl 3 6 5 COC 6 5 + HCl
Առաջին և երկրորդ ռեակցիաներում ձևավորվում է ացետոֆենոն (մեթիլֆենիլկետոն), ալյումինի քլորիդը փոխարինելով անտիմոնի քլորիդով, թույլ է տալիս ռեակցիայի ջերմաստիճանը նվազեցնել մինչև 25 ° C: Երրորդ ռեակցիայում ձևավորվում է բենզոֆենոն (դիֆենիլ կետոն):
- Ֆորմիլացման ռեակցիան - բենզոլի փոխազդեցությունը CO և HCl խառնուրդի հետ, ընթանում է բարձր ճնշման տակ և կատալիզատորի ազդեցության տակ, ռեակցիայի արտադրանքը բենզալդեհիդն է.
- Սուլֆոնացման և նիտրացման ռեակցիաներ (էլեկտրոֆիլային փոխարինում).
- Բենզոլի նվազեցում ջրածնով (կատալիտիկ ջրածինացում).
Օքսիդացման ռեակցիաներ
Բենզոլն իր կառուցվածքի շնորհիվ շատ դիմացկուն է օքսիդացման նկատմամբ, դրա վրա չի ազդում, օրինակ, կալիումի պերմանգանատի լուծույթը։ Այնուամենայնիվ, օքսիդացումը դեպի մալեյնային անհիդրիդ կարող է իրականացվել վանադիումի օքսիդի կատալիզատորի միջոցով.

- օզոնոլիզի ռեակցիա. Նաև բենզոլը ենթարկվում է օզոնոլիզացման, բայց գործընթացը ավելի դանդաղ է, քան չհագեցած ածխաջրածինների դեպքում.

Ռեակցիայի արդյունքը դիալդեհիդի՝ գլիոքսալի (1,2-էթանդիալ) առաջացումն է։
- այրման ռեակցիա. Բենզոլի այրումը օքսիդացման սահմանափակող դեպքն է։ Բենզոլը շատ դյուրավառ է և օդում այրվում է շատ ծխացող բոցով.
Կառուցվածք
Բենզոլը դասակարգվում է որպես չհագեցած ածխաջրածին ( հոմոլոգ շարք n 2n−6), բայց ի տարբերություն էթիլենային շարքի ածխաջրածինների, 2 4 , ցուցադրում է չհագեցած ածխաջրածիններին բնորոշ հատկություններ (դրանք բնութագրվում են հավելման ռեակցիաներով), միայն ծանր պայմաններում, բայց բենզոլն ավելի հակված է փոխարինման ռեակցիաներին։ Բենզոլի այս «վարքագիծը» բացատրվում է նրա հատուկ կառուցվածքով՝ նույն հարթության մեջ ատոմների առկայությամբ և կառուցվածքում զուգակցված 6π-էլեկտրոնային ամպի առկայությամբ։ Բենզոլում կապերի էլեկտրոնային բնույթի ժամանակակից գաղափարը հիմնված է Լինուս Պաուլինգի վարկածի վրա, ով առաջարկել է բենզոլի մոլեկուլը պատկերել որպես վեցանկյուն՝ ներգծված շրջանով, դրանով իսկ ընդգծելով ֆիքսված կրկնակի կապերի բացակայությունը և մեկ էլեկտրոնային ամպ, որը ծածկում է ցիկլի բոլոր վեց ածխածնի ատոմները:
Մասնագիտացված և հանրամատչելի գրականության մեջ տերմինը բենզոլային օղակ, նկատի ունենալով, որպես կանոն, բենզոլի ածխածնային կառուցվածքը՝ առանց հաշվի առնելու ածխածնի ատոմների հետ կապված այլ ատոմներ և խմբեր։ Բենզոլի օղակը շատ տարբեր միացությունների մի մասն է:
Արտադրություն
Մինչ օրս բենզոլի արտադրության մի քանի սկզբունքորեն տարբեր մեթոդներ կան:

Դիմում

Բենզոլի փոխադրումը երկաթուղով իրականացվում է մասնագիտացված ավտոցիստեռններով
Ստացված բենզոլի զգալի մասը օգտագործվում է այլ արտադրանքների սինթեզի համար.
- բենզոլի մոտ 50%-ը վերածվում է էթիլբենզոլի (բենզոլի ալկիլացում էթիլենով);
- բենզոլի մոտ 25%-ը վերածվում է կումենի (բենզոլի ալկիլացում պրոպիլենով);
- բենզոլի մոտավորապես 10-15%-ը հիդրոգենացվում է ցիկլոհեքսանի;
- Բենզոլի մոտ 10%-ը ծախսվում է նիտրոբենզոլի արտադրության վրա.
- Բենզոլի 2-3%-ը վերածվում է գծային ալկիլբենզոլների;
- Բենզոլի մոտավորապես 1%-ն օգտագործվում է քլորոբենզոլի սինթեզի համար։
Շատ ավելի փոքր քանակությամբ բենզոլն օգտագործվում է որոշ այլ միացությունների սինթեզի համար։ Երբեմն և ծայրահեղ դեպքերում, բարձր թունավորության պատճառով, բենզոլն օգտագործվում է որպես լուծիչ։
Բացի այդ, բենզինը բենզինի մի մասն է: 1920-ականներին և 1930-ականներին բենզոլը ավելացվեց «ru de» ուղիղ բենզինին՝ նրա օկտանային վարկանիշը բարձրացնելու համար, սակայն 1940-ականներին նման խառնուրդները չէին կարող մրցել բարձր օկտանային բենզինների հետ: Բարձր թունավորության պատճառով վառելիքում բենզոլի պարունակությունը ժամանակակից չափանիշներով սահմանափակվում է մինչև 1% ներմուծմամբ:
Կենսաբանական գործողություն և թունաբանություն
Բենզոլը ամենատարածված մարդածին քսենոբիոտիկներից մեկն է:
Բենզոլը շատ թունավոր է: Բերանի ընդունման համար նվազագույն մահացու չափաբաժինը 15 մլ է, միջինը 50-70 մլ: Բենզոլի գոլորշիների կարճ ներշնչմամբ անմիջապես թունավորում չի առաջանում, հետևաբար, մինչև վերջերս, բենզոլի հետ աշխատելու կարգը առանձնապես կանոնակարգված չէր: Մեծ չափաբաժիններով բենզոլը առաջացնում է սրտխառնոց և գլխապտույտ, իսկ որոշ ծանր դեպքերում թունավորումը կարող է մահացու լինել: Բենզոլով թունավորման առաջին նշանը հաճախ էյֆորիան է: Բենզոլի գոլորշին կարող է թափանցել անձեռնմխելի մաշկ: Հեղուկ բենզոլը բավականին գրգռում է մաշկը։ Եթե մարդու մարմինը ենթարկվում է բենզոլի երկարատև ազդեցությանը փոքր քանակությամբ, ապա հետևանքները նույնպես կարող են շատ լուրջ լինել:
Բենզոլը ուժեղ քաղցկեղածին է: Ուսումնասիրությունները ցույց են տալիս բենզոլի կապը այնպիսի հիվանդությունների հետ, ինչպիսիք են ապլաստիկ անեմիան, սուր լեյկոզը (միելոիդ, լիմֆոբլաստիկ), քրոնիկ միելոիդ լեյկոզը, միելոդիսպլաստիկ համախտանիշը և ոսկրածուծի հիվանդությունները:
Բենզոլի փոխակերպման և մուտագեն ազդեցության մեխանիզմը
Մարդու մարմնում բենզոլի փոխակերպման մեխանիզմի մի քանի տարբերակներ կան. Առաջին տարբերակում բենզոլի մոլեկուլը հիդրոքսիլացվում է միկրոզոմային օքսիդացման համակարգով՝ ցիտոքրոմ P450-ի մասնակցությամբ։ Ըստ մեխանիզմի՝ բենզոլը սկզբում օքսիդացվում է բարձր ռեակտիվ էպոօքսիդի, որը հետագայում վերածվում է ֆենոլի։ Բացի այդ, ազատ ռադիկալներ (ռեակտիվ թթվածնի տեսակներ) առաջանում են P450-ի բարձր ակտիվացման շնորհիվ՝ ըստ ռեակցիայի.
Բենզոլի մուտագենեզի մոլեկուլային մեխանիզմ
Բենզոլն է պրոմուտագեն, մուտագեն հատկություն է ձեռք բերում միայն կենսատրանսֆորմացիայից հետո, որի արդյունքում առաջանում են բարձր ռեակտիվ միացություններ։ Դրանցից մեկը բենզոլի էպօքսիդն է: Էպոքսիդային ցիկլի բարձր անկյունային լարվածության պատճառով -C-O-C- կապերը կոտրվում են, և մոլեկուլը դառնում է էլեկտրոֆիլ, այն հեշտությամբ արձագանքում է նուկլեոֆիլ կենտրոնների հետ։ ազոտային հիմքերմոլեկուլները նուկլեինաթթուներհատկապես ԴՆԹ.
Էպոքսիդային ցիկլի փոխազդեցության մեխանիզմը նուկլեոֆիլ կենտրոնների հետ՝ ազոտային հիմքերի ամինո խմբեր (արիլացման ռեակցիա) ընթանում է որպես նուկլեոֆիլ փոխարինող ռեակցիա։ 2 . Արդյունքում ձևավորվում են բավականին ուժեղ կովալենտային կապակցված ԴՆԹ հավելումներ, ամենից հաճախ այդպիսի ածանցյալներ նկատվում են գուանինում (քանի որ գուանինի մոլեկուլն ունի առավելագույն թվով նուկլեոֆիլ կենտրոններ), օրինակ՝ N7-ֆենիլգուանին։ Ստացված ԴՆԹ-ի հավելումները կարող են հանգեցնել ԴՆԹ-ի բնիկ կառուցվածքի փոփոխության՝ դրանով իսկ խաթարելով տառադարձման և վերարտադրության ճիշտ ընթացքը: Որն է գենետիկ մուտացիաների աղբյուրը. Հեպատոցիտներում (լյարդի բջիջներում) էպօքսիդի կուտակումը հանգեցնում է անդառնալի հետևանքների. ապոպտոզի արգելակում; բջիջների վերափոխում և նույնիսկ մահ: Բացի ընդգծված գենոտոքսիկությունից և մուտագենությունից, բենզոլն ունի ուժեղ միելոտոքսիկություն և քաղցկեղածին ակտիվություն, հատկապես այս ազդեցությունը դրսևորվում է միելոիդ հյուսվածքի բջիջներում (այս հյուսվածքի բջիջները շատ զգայուն են այս տեսակի քսենոբիոտիկ ազդեցությունների նկատմամբ):
Բենզոլ և թմրամիջոցների չարաշահում
Բենզոլը ապշեցուցիչ ազդեցություն է թողնում մարդու վրա և կարող է հանգեցնել թմրամոլության։
Սուր թունավորում
Շատ բարձր կոնցենտրացիաների դեպքում՝ գիտակցության գրեթե ակնթարթային կորուստ և մահ մի քանի րոպեի ընթացքում: Դեմքի գույնը ցիանոտ է, լորձաթաղանթները հաճախ բալի կարմիր են։ Ավելի ցածր կոնցենտրացիաների դեպքում - գրգռում, որը նման է ալկոհոլին, ապա քնկոտություն, ընդհանուր թուլություն, գլխապտույտ, սրտխառնոց, փսխում, գլխացավ, գիտակցության կորուստ. Նկատվում են նաև մկանային ցնցումներ, որոնք կարող են վերածվել տոնիկ ցնցումների։ Աչքերը հաճախ լայնացած են և չեն արձագանքում լույսին: Շնչառությունը սկզբում արագանում է, հետո դանդաղում։ Մարմնի ջերմաստիճանը կտրուկ նվազում է. Զարկերակի արագացում, փոքր լցոնում: Արյան ճնշումն իջեցված է։ Արձանագրվել են սրտի ծանր առիթմիայի դեպքեր:
Ծանր թունավորումից հետո, որն ուղղակիորեն մահվան չի հանգեցնում, երբեմն նկատվում են առողջական երկարատև խանգարումներ՝ պլերիտ, վերին շնչուղիների կատարրներ, եղջերաթաղանթի և ցանցաթաղանթի հիվանդություններ, լյարդի վնասում, սրտի խանգարումներ և այլն: Վազոմոտորի դեպք։ նևրոզ դեմքի և վերջույթների այտուցմամբ, զգայունության խանգարումներով և ցնցումներով բենզոլով սուր թունավորումից անմիջապես հետո: Երբեմն մահը տեղի է ունենում թունավորումից որոշ ժամանակ անց:
քրոնիկ թունավորում
Ծանր դեպքերում լինում են՝ գլխացավեր, ծայրահեղ հոգնածություն, շնչահեղձություն, գլխապտույտ, թուլություն, նյարդայնություն, քնկոտություն կամ անքնություն, մարսողության խանգարում, սրտխառնոց, երբեմն փսխում, ախորժակի բացակայություն, միզարձակման ավելացում, դաշտան, հաճախ զարգանում է բերանի լորձաթաղանթից համառ արյունահոսություն: , հատկապես լնդերը և քիթը, որը տևում է ժամերով և նույնիսկ օրերով: Երբեմն ատամի արդյունահանումից հետո մշտական արյունահոսություն է առաջանում: Մաշկի բազմաթիվ մանր արյունազեղումներ (արյունազեղումներ): Արյուն կղանքում, արգանդի արյունահոսություն, ցանցաթաղանթի արյունահոսություն: Սովորաբար հենց արյունահոսությունն է, և հաճախ ուղեկցող ջերմությունը (ջերմաստիճանը մինչև 40 ° և բարձր), որը թունավորվածին բերում է հիվանդանոց։ Նման դեպքերում կանխատեսումը միշտ լուրջ է։ Մահվան պատճառը երբեմն երկրորդական վարակներն են՝ լինում են պերիոստեումի գանգրենոզ բորբոքման և ծնոտի նեկրոզի դեպքեր, լնդերի ծանր խոցային բորբոքում, ընդհանուր սեպսիս՝ սեպտիկ էնդոմետիտով։
Երբեմն, ծանր թունավորմամբ, զարգանում են նյարդային հիվանդությունների ախտանիշներ. ջիլային ռեֆլեքսների ավելացում, երկկողմանի կլոնուս, Բաբինսկու դրական ախտանիշ, խորը զգայունության խանգարում, պսևդո-տաբետիկ խանգարումներ պարեստեզիայով, ատաքսիայով, պարապլեգիայով և շարժիչային խանգարումներով (հետևի սյուների վնասման նշաններ: ողնաշարի լարըև բրգաձև ուղիներ):
Արյան մեջ ամենատիպիկ փոփոխությունները. Սովորաբար էրիթրոցիտների թիվը կտրուկ կրճատվում է` մինչև 1-2 միլիոն և ցածր: Կտրուկ նվազում է նաև հեմոգլոբինի պարունակությունը՝ երբեմն մինչև 10%։ Գույնի ինդեքսը որոշ դեպքերում ցածր է, երբեմն նորմալին մոտ, իսկ երբեմն բարձր է (հատկապես ծանր անեմիայի դեպքում): Նշվում է անիսոցիտոզ և պոիկիլոցիտոզ, բազոֆիլային պունկցիա և միջուկային էրիթրոցիտների առաջացում, ռետիկուլոցիտների քանակի և էրիթրոցիտների ծավալի ավելացում։ Առավել բնորոշ է լեյկոցիտների քանակի կտրուկ նվազումը։ Երբեմն սկզբում լեյկոցիտոզը, որը արագ փոխարինվում է լեյկոպենիայով, ESR-ի արագացում: Արյան մեջ փոփոխությունները միաժամանակ չեն զարգանում։ Ամենից հաճախ լեյկոպոետիկ համակարգը ավելի վաղ է ախտահարվում, ավելի ուշ միանում է թրոմբոցիտոպենիան։ Պարտությունը erythroblastic ֆունկցիայի հաճախ տեղի է ունենում նույնիսկ ավելի ուշ: Ապագայում կարող է զարգանալ ծանր թունավորման բնորոշ պատկեր՝ ապլաստիկ անեմիա։
Թունավորման հետևանքները կարող են պահպանվել և նույնիսկ զարգանալ բենզոլի հետ աշխատանքի դադարեցումից ամիսներ և տարիներ անց:
Առաջին օգնություն թունավորման և բուժման համար
ժամը սուր թունավորումբենզոլ (բենզոլի գոլորշի), տուժածին նախ պետք է տանել մաքուր օդ, շնչառության կանգի դեպքում կատարվում է արհեստական շնչառություն՝ նորմալացնելու համար, թթվածինը և լոբելինը օգտագործվում են որպես շնչառական խթանիչներ։ Ադրենալինի օգտագործումը որպես անալեպտիկ միջոց խստիվ արգելված է: Եթե առաջանում է փսխում, ներերակային 40% գլյուկոզայի լուծույթ, արյան շրջանառության խանգարումների դեպքում՝ կոֆեինի լուծույթի ներարկում։ Եթե թունավորումը տեղի է ունեցել բանավոր, և բենզոլը հայտնվել է ստամոքսի մեջ, ապա անհրաժեշտ է այն ողողել բուսական յուղով (բենզոլը լավ ներծծվում է), ընթացակարգը պետք է իրականացվի զգուշությամբ, քանի որ հնարավոր է ասպիրացիա: Թեթև թունավորմամբ հիվանդին ցուցադրվում է հանգիստ: Հուզված վիճակներում անհրաժեշտ են հանգստացնող միջոցներ։ Անեմիայի դեպքում կատարվում է արյան փոխներարկում, վիտամին B12, ֆոլաթթու, լեյկոպենիայի դեպքում՝ վիտամին B6, պենտոքսիլ։ Իմունիտետի նվազման դեպքում (իմունային անբավարարության վիճակ)՝ իմունոստիմուլյատորներ։
Բենզոլի ազդեցությունը կենսամեմբրանների վրա
Կենսաբանական թաղանթները վերմոլեկուլային կառուցվածքներ են՝ կրկնակի լիպիդային շերտ, որի մեջ սպիտակուցների և պոլիսախարիդների մոլեկուլները ինտեգրված են (ներկառուցված) կամ կցվում են մակերեսին: Կենսաթաղանթները կազմող լիպիդներն իրենց բնույթով ամֆիֆիլային (ամոֆիլ) միացություններ են, այսինքն՝ ընդունակ են լուծարվել ինչպես բևեռային, այնպես էլ ոչ բևեռ նյութերում, դրանցում բևեռային խմբերի առկայության պատճառով, այսպես կոչված. "գլուխ"(կարբոքսիլային -COOH, հիդրոքսիլ -OH, ամինային խմբեր -NH 2 և այլն) և ոչ բևեռային այսպես կոչված. «պոչեր»(ածխաջրածնային ռադիկալներ - ալկիլներ, արիլներ, պոլիցիկլիկ կառուցվածքներ, ինչպիսիք են խոլեստանը և այլն):
Բենզոլը կենսաբանական թաղանթների արդյունավետ լուծիչ է, այն արագորեն լուծում է ոչ բևեռային խմբերը (այսպես կոչված ածխաջրածինները «պոչեր») լիպիդներ, հիմնականում խոլեստերին, որը թաղանթների մի մասն է: Լուծման գործընթացը սահմանափակվում է բենզոլի կոնցենտրացիայով, որքան շատ է այն, այնքան արագ է ընթանում այս գործընթացը։ Լուծման գործընթացում էներգիա է արտազատվում՝ բառացիորեն կոտրելով կրկնակի լիպիդային շերտը (լիպիդային երկշերտ), ինչը հանգեցնում է մեմբրանի ամբողջական ոչնչացման (կառուցվածքի քայքայմանը) և հետագա բջիջների ապոպտոզի (կենսաթաղանթների ոչնչացման ժամանակ թաղանթային ընկալիչները ակտիվանում են (օրինակ՝ ինչպես՝ CD95, TNFR1, DR3, DR4 և այլն), որոնք ակտիվացնում են բջջային ապոպտոզը):
Գործողություն մաշկի վրա
Բենզոլի հետ ձեռքերի հաճախակի շփման դեպքում նկատվում է չոր մաշկ, ճաքեր, քոր, կարմրություն (սովորաբար մատների միջև), այտուց, կորեկի նման պղպջակներ։ Երբեմն մաշկային վնասվածքների պատճառով աշխատողները ստիպված են լինում թողնել իրենց աշխատանքը:
Առավելագույն թույլատրելի կոնցենտրացիան 5 մգ/մ 3 է:
Անվտանգություն
Բենզոլի հետ աշխատելը թունավորման և առողջական լուրջ խնդիրների վտանգ է պարունակում: Բենզոլը խիստ ցնդող հեղուկ է (ցնդողությունը 320 մգ/լ 20°C-ում) բարձր աստիճանբոցավառումը, հետևաբար, դրա հետ աշխատելիս անհրաժեշտ է պահպանել դյուրավառ հեղուկների հետ աշխատելու անվտանգության նախազգուշական միջոցները: Բենզոլի գոլորշիները մեծ վտանգ են ներկայացնում, քանի որ օդի հետ կարող են պայթուցիկ խառնուրդներ առաջացնել։ Ներկայումս բենզոլի օգտագործումը որպես օրգանական լուծիչ խիստ սահմանափակ է՝ դրա գոլորշիների թունավորության և քաղցկեղածին ազդեցության պատճառով։ բացասական ազդեցությունմաշկի վրա։ Լաբորատորիաներում բենզոլի հետ աշխատելը նախատեսում է նաև դրա սահմանափակում (խիստ կարգավորվող): Փորձարկումներում խորհուրդ է տրվում օգտագործել բենզոլը միայն փոքր ծավալներով (50 մլ-ից ոչ ավելի), աշխատանքը պետք է իրականացվի բացառապես ֆտորէլաստոմերից պատրաստված ձեռնոցներով (լատեքսը լուծվում և ուռչում է բենզոլի ազդեցության դեպքում):
- պահել ջերմության աղբյուրների, բաց կրակի, ուժեղ օքսիդացնող նյութերի, սննդամթերքի և այլնի մոտ,
- թողնել բենզոլ պարունակող տարաները բաց, ծուխ,
- օգտագործել բենզոլային տարաներ սննդի օգտագործման, ձեռքերը լվանալու, սպասքի համար,
- աշխատել 30 ° C-ից ավելի օդի ջերմաստիճանով փակ, վատ օդափոխվող սենյակում,
- օգտագործել նյութի մեծ ծավալը որպես լուծիչ,
- աշխատել առանց ձեռքերի մաշկի, աչքերի և շնչառական օրգանների պաշտպանիչ սարքավորումների.
Էկոլոգիա
Բենզոլը էկոլոգիապես ոչ անվտանգ նյութ է, մարդածին ծագման թունավոր նյութ: Մտնող բենզոլի հիմնական աղբյուրները միջավայրըընկ կոյուղաջրերկամ օդային արտանետումները նավթաքիմիական և կոքսի արդյունաբերություններն են, վառելիքի արտադրությունը և տրանսպորտը: Ջրամբարներից բենզոլը հեշտությամբ ցնդվում է, ունակ է հողից վերածվել բույսերի, ինչը լուրջ վտանգ է ներկայացնում էկոհամակարգերի համար։
Բենզոլն ունի կուտակման հատկություն, իր լիպոֆիլության շնորհիվ այն կարողանում է նստել կենդանիների ճարպային հյուսվածքի բջիջներում՝ դրանով իսկ թունավորելով նրանց։
Արոմատիկ HCs (արենաներ)ածխաջրածիններ են, որոնց մոլեկուլները պարունակում են մեկ կամ մի քանի բենզոլային օղակներ։
Արոմատիկ ածխաջրածինների օրինակներ.

Բենզոլային շարքի ասպարեզներ (միացիկլիկ արենաներ)
Ընդհանուր բանաձև.C n H 2n-6, n≥6
Արոմատիկ ածխաջրածինների ամենապարզ ներկայացուցիչը բենզոլն է, նրա էմպիրիկ բանաձևը՝ C 6 H 6:
Բենզոլի մոլեկուլի էլեկտրոնային կառուցվածքը
C n H 2 n -6 միացիկլիկ արենների ընդհանուր բանաձեւը ցույց է տալիս, որ դրանք չհագեցած միացություններ են։
1856 թվականին գերմանացի քիմիկոս Ա.Ֆ. Կեկուլեն առաջարկել է բենզոլի ցիկլային բանաձև՝ խոնարհված կապերով (մեկ և կրկնակի կապեր այլընտրանքային)՝ ցիկլոհեքսատրիեն-1,3,5. 
Բենզոլի մոլեկուլի այս կառուցվածքը չի բացատրում բենզոլի շատ հատկություններ.
- Բենզոլի համար բնորոշ են փոխարինման ռեակցիաները, և ոչ թե չհագեցած միացություններին բնորոշ ավելացման ռեակցիաները։ Ավելացման ռեակցիաները հնարավոր են, բայց դրանք ավելի դժվար են, քան համար;
- բենզոլը չի մտնում ռեակցիաների մեջ, որոնք որակական ռեակցիաներ են չհագեցած ածխաջրածիններին (բրոմ ջրով և KMnO 4 լուծույթով):
Հետագայում իրականացված էլեկտրոնի դիֆրակցիոն ուսումնասիրությունները ցույց են տվել, որ բենզոլի մոլեկուլում ածխածնի ատոմների միջև եղած բոլոր կապերն ունեն նույն երկարությունը՝ 0,140 նմ (միջին արժեքը պարզ մոլեկուլի երկարության միջև։ C-C միացումներ 0,154 նմ և C=C կրկնակի կապ 0,134 նմ): Յուրաքանչյուր ածխածնի ատոմում կապերի միջև անկյունը 120° է։ Մոլեկուլը կանոնավոր հարթ վեցանկյուն է։
C 6 H 6 մոլեկուլի կառուցվածքը բացատրելու ժամանակակից տեսությունը օգտագործում է ատոմային օրբիտալների հիբրիդացման հայեցակարգը:
Բենզոլում ածխածնի ատոմները գտնվում են sp 2 հիբրիդացման վիճակում։ Յուրաքանչյուր «C» ատոմ ձևավորում է երեք σ-կապ (երկուսը ածխածնի ատոմներով և մեկը՝ ջրածնի ատոմով)։ Բոլոր σ կապերը գտնվում են նույն հարթության վրա.
Ածխածնի յուրաքանչյուր ատոմ ունի մեկ p-էլեկտրոն, որը չի մասնակցում հիբրիդացմանը։ Ածխածնի ատոմների չհիբրիդացված p-օրբիտալները գտնվում են σ-կապերի հարթությանը ուղղահայաց հարթությունում։ Յուրաքանչյուր p-ամպ համընկնում է երկու հարեւան p-ամպերի հետ, և արդյունքում ձևավորվում է մեկ խոնարհված π-համակարգ (հիշեք p-էլեկտրոնների միացման ազդեցությունը 1,3-բուտադիենի մոլեկուլում, որը քննարկվել է «Դիենի ածխաջրածիններ» թեմայում »):
Վեց σ-կապերի համակցությունը մեկ π-համակարգի հետ կոչվում է անուշաբույր կապ.
Ածխածնի վեց ատոմներից բաղկացած օղակը, որը կապված է անուշաբույր կապով, կոչվում է բենզոլային օղակ,կամ բենզոլի միջուկ.
մասին ժամանակակից պատկերացումներին համապատասխան էլեկտրոնային կառուցվածքըբենզոլ, C 6 H 6 մոլեկուլը պատկերված է հետևյալ կերպ.

Բենզոլի ֆիզիկական հատկությունները
Բենզոլը ժամը նորմալ պայմաններ- անգույն հեղուկ; t o pl = 5,5 o C; t o kip. = 80 մոտ C; ունի բնորոշ հոտ; ջրի հետ չխառնվող, լավ լուծիչ, խիստ թունավոր:
Բենզոլի քիմիական հատկությունները
Արոմատիկ կապը սահմանում է Քիմիական հատկություններբենզոլ և այլ անուշաբույր ածխաջրածիններ:
6π-էլեկտրոնային համակարգը ավելի կայուն է, քան սովորական երկէլեկտրոնային π-կապերը: Հետեւաբար, հավելման ռեակցիաները ավելի քիչ բնորոշ են արոմատիկ ածխաջրածիններին, քան չհագեցած ածխաջրածիններին։ Արենների համար առավել բնորոշ են փոխարինման ռեակցիաները։
Ի. Փոխարինման ռեակցիաներ
1. Հալոգենացում

2. Նիտրացիա
Ռեակցիան իրականացվում է թթուների և թթուների խառնուրդով (նիտրացնող խառնուրդ). 
3. Սուլֆոնացիա

4. Ալկիլացում («H» ատոմի փոխարինում ալկիլ խմբով) - Friedel-Crafts-ի ռեակցիաները, առաջանում են բենզոլի հոմոլոգներ.

Հալոալկանների փոխարեն կարող են օգտագործվել ալկեններ (կատալիզատորի առկայության դեպքում՝ AlCl 3 կամ անօրգանական թթու).

II. Ավելացման ռեակցիաներ
1. Հիդրոգենացում

2. Քլորի ավելացում

III.Օքսիդացման ռեակցիաներ
1. Այրում
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O
2. Անավարտ օքսիդացում (KMnO 4 կամ K 2 Cr 2 O 7 թթվային միջավայրում): Բենզոլային օղակը դիմացկուն է օքսիդացնող նյութերի նկատմամբ: Ռեակցիան չի առաջանում:
Բենզոլի ստացում
Արդյունաբերության մեջ.
1) նավթի և ածխի վերամշակում.
2) ցիկլոհեքսանի ջրազրկումը.

3) հեքսանի դեհիդրոցիկլացում (արոմատացում).

Լաբորատորիայում.
Բենզոաթթվի աղերի միաձուլումը հետևյալի հետ.

Բենզոլի հոմոլոգների իզոմերիզմ և նոմենկլատուրա
Բենզոլի ցանկացած հոմոլոգ ունի կողային շղթա, այսինքն. բենզոլային օղակին կցված ալկիլային ռադիկալներ: Բենզոլի առաջին հոմոլոգը բենզոլի միջուկ է՝ կապված մեթիլ ռադիկալի հետ. 
Տոլուոլը չունի իզոմերներ, քանի որ բենզոլի օղակի բոլոր դիրքերը համարժեք են:
Բենզոլի հետագա հոմոլոգների համար հնարավոր է իզոմերիզմի մեկ տեսակ՝ կողային շղթայի իզոմերիզմ, որը կարող է լինել երկու տեսակի.
1) փոխարինողների քանակի և կառուցվածքի իզոմերիզմ.
2) փոխարինողների դիրքի իզոմերիզմ.



Տոլուոլի ֆիզիկական հատկությունները
Տոլուոլ- անգույն հեղուկ՝ բնորոշ հոտով, ջրում չլուծվող, օրգանական լուծիչներում լուծվող։ Տոլուոլն ավելի քիչ թունավոր է, քան բենզոլը:
Տոլուոլի քիմիական հատկությունները
Ի. Փոխարինման ռեակցիաներ
1. Բենզոլային օղակի հետ կապված ռեակցիաներ
Մեթիլբենզոլը մտնում է բոլոր փոխարինող ռեակցիաների մեջ, որոնցում ներգրավված է բենզոլը, և միևնույն ժամանակ ցուցադրում է ավելի բարձր ռեակտիվություն, ռեակցիաներն ընթանում են ավելի արագ տեմպերով:
Տոլուոլի մոլեկուլում պարունակվող մեթիլ ռադիկալը սեռի փոխարինող է, հետևաբար, բենզոլի միջուկում փոխարինման ռեակցիաների արդյունքում ստացվում են տոլուոլի օրթո- և պարաածանցյալներ կամ ռեագենտի ավելցուկով՝ եռածանցյալներ։ ընդհանուր բանաձևի.

ա) հալոգենացում


Հետագա քլորացմամբ կարելի է ձեռք բերել դիքլորմեթիլբենզոլ և տրիքլորմեթիլբենզոլ.

II. Ավելացման ռեակցիաներ
հիդրոգենացում

III.Օքսիդացման ռեակցիաներ
1. Այրում
C 6 H 5 CH 3 + 9O 2 → 7CO 2 + 4H 2 O
2. Անավարտ օքսիդացում
Ի տարբերություն բենզոլի, նրա հոմոլոգները օքսիդացված են որոշ օքսիդացնող նյութերով. այս դեպքում օքսիդացման է ենթարկվում կողային շղթան, տոլուոլի դեպքում՝ մեթիլ խումբը։ Թեթև օքսիդացնող նյութերը, ինչպիսին MnO 2-ն է, այն օքսիդացնում են ալդեհիդային խմբի, իսկ ավելի ուժեղ օքսիդացնող նյութերը (KMnO 4) առաջացնում են հետագա օքսիդացում մինչև թթու. 
Մեկ կողային շղթայով բենզոլի ցանկացած հոմոլոգ օքսիդացվում է ուժեղ օքսիդացնող նյութով, ինչպիսին է KMnO4-ը, վերածվում բենզոյական թթվի, այսինքն. կողային շղթայում առկա է ճեղքվածք՝ դրա ճեղքված մասի CO 2-ի օքսիդացումով. Օրինակ: 
Մի քանի կողային շղթաների առկայության դեպքում նրանցից յուրաքանչյուրը օքսիդացվում է կարբոքսիլային խմբի և արդյունքում ձևավորվում են պոլիբազային թթուներ, օրինակ.

Տոլյուոլի ստացում.
Արդյունաբերության մեջ.
1) նավթի և ածխի վերամշակում.
2) մեթիլցիկլոհեքսանի ջրազրկումը.

3) հեպտանի ջրազերծում.
Լաբորատորիայում.
1) Friedel-Crafts ալկիլացում;
2) Վուրց-Ֆիտգի ռեակցիա(նատրիումի ռեակցիա հալոբենզոլի և հալոալկանի խառնուրդի հետ):
Ֆիզիկական հատկություններ
Բենզոլը և նրա ամենամոտ հոմոլոգները անգույն հեղուկներ են՝ հատուկ հոտով։ Արոմատիկ ածխաջրածիններն ավելի թեթև են, քան ջուրը և չեն լուծվում դրա մեջ, սակայն հեշտությամբ լուծվում են օրգանական լուծիչներում՝ սպիրտ, եթեր, ացետոն։
Բենզոլը և նրա հոմոլոգներն իրենք լավ լուծիչներ են շատերի համար օրգանական նյութեր. Բոլոր ասպարեզներն այրվում են ծխագույն բոցով` իրենց մոլեկուլներում ածխածնի բարձր պարունակության պատճառով:
Որոշ արենների ֆիզիկական հատկությունները ներկայացված են աղյուսակում:
Աղյուսակ. Որոշ ասպարեզների ֆիզիկական հատկություններ
|
Անուն |
Բանաձև |
t°.pl., |
t°.bp., |
|
Բենզոլ |
C 6 H 6 |
5,5 |
80,1 |
|
տոլուոլ (մեթիլբենզոլ) |
C 6 H 5 CH 3 |
95,0 |
110,6 |
|
Էթիլբենզոլ |
C 6 H 5 C 2 H 5 |
95,0 |
136,2 |
|
Քսիլեն (դիմեթիլբենզոլ) |
C 6 H 4 (CH 3) 2 |
||
|
օրթո- |
25,18 |
144,41 |
|
|
մետա- |
47,87 |
139,10 |
|
|
զույգ- |
13,26 |
138,35 |
|
|
Պրոպիլբենզոլ |
C 6 H 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
Կումեն (իզոպրոպիլբենզոլ) |
C 6 H 5 CH (CH 3) 2 |
96,0 |
152,39 |
|
Ստիրոլ (վինիլբենզոլ) |
C 6 H 5 CH \u003d CH 2 |
30,6 |
145,2 |
Բենզոլ - ցածր եռման ( տկիպ= 80,1°C), անգույն հեղուկ, ջրում չլուծվող
Ուշադրություն. Բենզոլ - թույն է, գործում է երիկամների վրա, փոխում է արյան բանաձևը (երկարատև ազդեցության դեպքում), կարող է խաթարել քրոմոսոմների կառուցվածքը։
Արոմատիկ ածխաջրածինների մեծ մասը կյանքին սպառնացող և թունավոր է:
Արենների ստացում (բենզոլ և նրա հոմոլոգները)
Լաբորատորիայում
1. Բենզոյան թթվի աղերի միաձուլումը պինդ ալկալիների հետ
C 6 H 5 -COONa + NaOH t → C 6 H 6 + Na 2 CO 3
նատրիումի բենզոատ
2. Wurtz-Fitting ռեակցիա: (այստեղ G-ը հալոգեն է)
6-իցՀ 5 -G+2Նա + Ռ-Գ →Գ 6 Հ 5 - Ռ + 2 ՆաԳ
ՀԵՏ 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
Արդյունաբերության մեջ
- մեկուսացված նավթից և ածուխից մասնակի թորման միջոցով, բարեփոխում;
- ածխի խեժից և կոքսի վառարանի գազից
1. Ալկանների ջրազերծումավելի քան 6 ածխածնի ատոմներով.
C 6 H 14 տ , կատ→C 6 H 6 + 4H 2
2. Ացետիլենի տրիմերացում(միայն բենզոլի համար) – Ռ. Զելինսկին:
3C 2 Հ2 600°Գ, Գործ. ածուխ→ C 6 H 6
3. Ջրազրկումցիկլոհեքսան և նրա հոմոլոգները.
Խորհրդային ակադեմիկոս Նիկոլայ Դմիտրիևիչ Զելինսկին հաստատել է, որ բենզոլը ձևավորվում է ցիկլոհեքսանից (ցիկլոալկանների ջրազրկում)
C 6 H 12 տ, կատու→C 6 H 6 + 3H 2

C 6 H 11 -CH 3 տ , կատ→C 6 H 5 -CH 3 + 3H 2
մեթիլցիկլոհեքսանտոլուոլ
4. Բենզոլի ալկիլացում(բենզոլի հոմոլոգների ստացում) – r Friedel-Crafts.
C 6 H 6 + C 2 H 5 -Cl t, AlCl3→C 6 H 5 -C 2 H 5 + HCl
քլորէթան էթիլբենզոլ

Արենների քիմիական հատկությունները
Ի. ՕՔՍԻԴԱՑՄԱՆ ՌԵԱԿՑԻԱՆԵՐ
1. Այրում (ծխացող բոց).
2C 6 H 6 + 15O 2 տ→12CO 2 + 6H 2 O + Q
2. Բենզոլը նորմալ պայմաններում չի գունազրկում բրոմային ջուրը և ջրի լուծույթկալիումի պերմանգանատ
3. Բենզոլի հոմոլոգները օքսիդանում են կալիումի պերմանգանատով (գունաթափում է կալիումի պերմանգանատը).
Ա) թթվային միջավայրում մինչև բենզոաթթու
Բենզոլի հոմոլոգների վրա կալիումի պերմանգանատի և այլ ուժեղ օքսիդանտների ազդեցության տակ կողային շղթաները օքսիդանում են։ Անկախ նրանից, թե որքան բարդ է փոխարինողի շղթան, այն քայքայվում է, բացառությամբ a-ածխածնի ատոմի, որը օքսիդացված է կարբոքսիլ խմբի:
Միակողմանի շղթայով բենզոլի հոմոլոգները բենզոյաթթու են տալիս.
Երկու կողային շղթաներ պարունակող հոմոլոգները տալիս են երկհիմնական թթուներ.
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 + 28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 + 14H 2 O
Պարզեցված :
C 6 H 5 -CH 3 + 3O KMnO4→C 6 H 5 COOH + H 2 O
Բ) չեզոք և թեթևակի ալկալային է բենզոաթթվի աղերի նկատմամբ
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K OH + 2MnO 2 + H 2 O
II. ԼՐԱՑՄԱՆ ԱՐՁԱԳԱՆՔՆԵՐ (ավելի կոշտ, քան ալկենները)
1. Հալոգենացում
C 6 H 6 + 3Cl 2 հ ν → C 6 H 6 Cl 6 (hexachlorocyclohexane - hexachloran)
2. Հիդրոգենացում
C 6 H 6 + 3H 2 տ , ՊտկամՆի→ C 6 H 12 (ցիկլոհեքսան)
3. Պոլիմերացում
III. ՓՈԽԱՐԻՆԱԿԱՆՈՒԹՅԱՆ ՌԵԱԿՑԻԱՆԵՐ - իոնային մեխանիզմ (ալկաններից թեթև)
1. Հալոգենացում -
ա ) բենզոլ
C 6 H 6 + Cl 2 AlCl 3 → C 6 H 5 -Cl + HCl (քլորբենզոլ)
C 6 H 6 + 6Cl 2 t,AlCl3→C 6 Cl 6 + 6HCl( հեքսաքլորբենզոլ)
C 6 H 6 + Br 2 t, FeCl3→ C 6 H 5 -Br + HBr( բրոմբենզոլ)
բ) բենզոլի հոմոլոգները ճառագայթման կամ տաքացման ժամանակ
Ալկիլային ռադիկալների քիմիական հատկությունները նման են ալկանների հատկություններին։ Ջրածնի ատոմները դրանցում փոխարինվում են հալոգեններով ազատ ռադիկալների մեխանիզմով։ Հետևաբար, կատալիզատորի բացակայության դեպքում տաքացումը կամ ուլտրամանուշակագույն ճառագայթումը հանգեցնում է կողային շղթայում արմատական փոխարինման ռեակցիայի: Բենզոլային օղակի ազդեցությունը ալկիլ փոխարինողների վրա հանգեցնում է նրան, որ ջրածնի ատոմը միշտ փոխարինվում է բենզոլի օղակի հետ անմիջականորեն կապված ածխածնի ատոմում (a-ածխածնի ատոմ):
1) C 6 H 5 -CH 3 + Cl 2 հ ν → C 6 H 5 -CH 2 -Cl + HCl
գ) բենզոլի հոմոլոգներ կատալիզատորի առկայության դեպքում
C 6 H 5 -CH 3 + Cl 2 AlCl 3 → (օրթայի խառնուրդ, ածանցյալների զույգ) +HCl
2. Նիտրացիա (ազոտական թթուով)
C 6 H 6 + HO-NO 2 t, H2SO4→C 6 H 5 -NO 2 + H 2 O
նիտրոբենզոլ - հոտը նուշ!
C 6 H 5 -CH 3 + 3HO-NO 2 t, H2SO4→ ՀԵՏ H 3 -C 6 H 2 (NO 2) 3 + 3H 2 O2,4,6-տրինիտրոտոլուոլ (տոլ, տրոտիլ)
Բենզոլի և նրա հոմոլոգների օգտագործումը
Բենզոլ C 6 H 6-ը լավ լուծիչ է: Բենզոլը որպես հավելում բարելավում է շարժիչային վառելիքի որակը։ Այն ծառայում է որպես հումք բազմաթիվ անուշաբույր օրգանական միացությունների արտադրության համար՝ նիտրոբենզոլ C 6 H 5 NO 2 (լուծիչ, դրանից ստացվում է անիլին), քլորոբենզոլ C 6 H 5 Cl, ֆենոլ C 6 H 5 OH, ստիրոլ և այլն։
Տոլուոլ C 6 H 5 -CH 3 - լուծիչ, որն օգտագործվում է ներկերի, թմրանյութերի և պայթուցիկ նյութերի արտադրության մեջ (տրոտիլ (տոլ) կամ 2,4,6-տրինիտրոտոլուոլ TNT):
Քսիլեն C 6 H 4 (CH 3) 2: Տեխնիկական քսիլենը երեք իզոմերների խառնուրդ է ( օրթո-, մետա- Եվ զույգ-քսիլեններ) - օգտագործվում է որպես լուծիչ և սկզբնական արտադրանք շատ օրգանական միացությունների սինթեզի համար:
Իզոպրոպիլբենզոլ C 6 H 5 -CH (CH 3) 2-ը ծառայում է ֆենոլ և ացետոն ստանալու համար:
Բենզոլի քլորի ածանցյալներըօգտագործվում է բույսերի պաշտպանության համար: Այսպիսով, H ատոմները բենզոլում քլորի ատոմներով փոխարինելու արդյունքը հեքսաքլորբենզոլն է C 6 Cl 6 - ֆունգիցիդ; այն օգտագործվում է ցորենի և աշորայի չոր սերմերի մշակման համար՝ պինդ կեղտի դեմ: Բենզոլին քլորի ավելացման արտադրանքը հեքսաքլորցիկլոհեքսան է (հեքսաքլորան) C 6 H 6 Cl 6 - միջատասպան; այն օգտագործվում է վնասակար միջատների դեմ պայքարելու համար։ Այդ նյութերը վերաբերում են թունաքիմիկատներին՝ միկրոօրգանիզմների, բույսերի և կենդանիների դեմ պայքարի քիմիական միջոցներին։
Ստիրոլ C 6 H 5 - CH \u003d CH 2-ը շատ հեշտությամբ պոլիմերացվում է ՝ ձևավորելով պոլիստիրոլ, և համապոլիմերանալով բութադիեն-ստիրոլ-բուտադիենային ռետիններով:
ՏԵՍԱՆՅՈՒԹԵՐԻ ՓՈՐՁ





