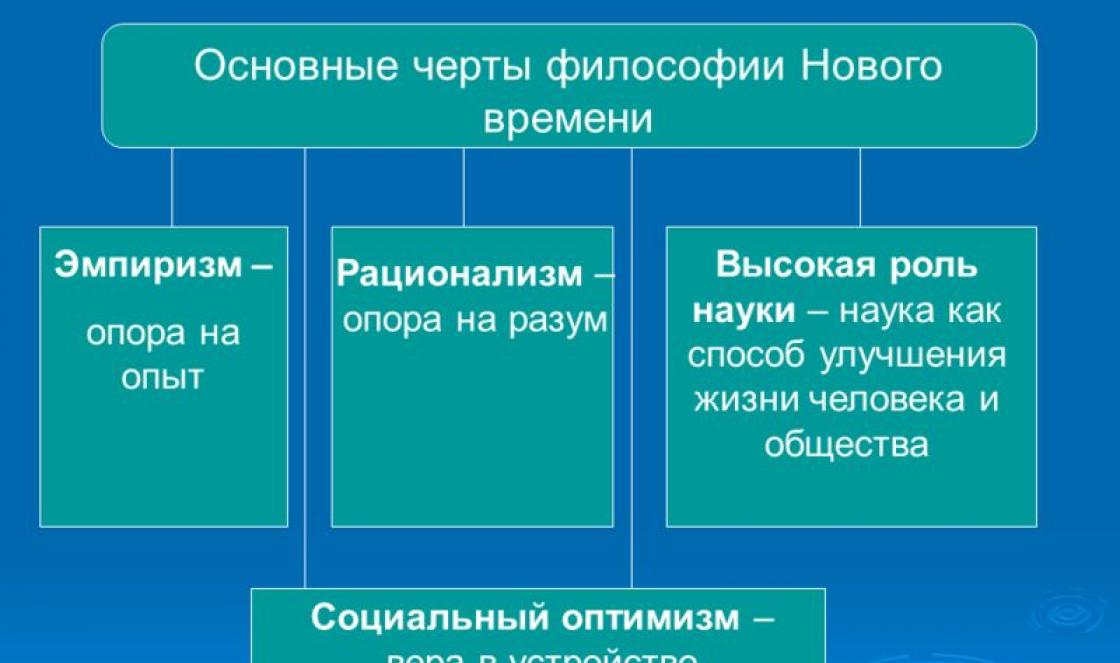
Bola to senzácia – ukazuje sa, že najdôležitejšiu látku na Zemi tvoria dva rovnako dôležité chemické prvky. "AiF" sa rozhodol nahliadnuť do periodickej tabuľky a spomenúť si, aké prvky a zlúčeniny existuje vo vesmíre, ako aj na život na Zemi a ľudskú civilizáciu.
VODÍK (H)
Kde sa stretáva: najbežnejší prvok vo vesmíre, jeho hlavný " Stavebný Materiál". Tvoria ho hviezdy vrátane slnka. Vďaka termonukleárnej fúzii s vodíkom bude Slnko ohrievať našu planétu ďalších 6,5 miliardy rokov.
Čo je užitočné: v priemysle - pri výrobe čpavku, mydla a plastov. Vodíková energia má veľkú perspektívu: tento plyn neznečisťuje životné prostredie, pretože pri horení dáva len vodnú paru.
UHLÍK (C)
Kde sa stretáva: Každý organizmus je z veľkej časti postavený z uhlíka. V ľudskom tele tento prvok zaberá asi 21%. Naše svaly sa teda skladajú z 2/3. Vo voľnom stave sa v prírode vyskytuje vo forme grafitu a diamantu.
Čo je užitočné: jedlo, energiu a pod. atď. Trieda zlúčenín na báze uhlíka je obrovská – uhľovodíky, bielkoviny, tuky atď. Tento prvok je v nanotechnológii nenahraditeľný.
DUSÍK (N)
Kde sa stretáva: Atmosféru Zeme tvorí 75 % dusíka. Je súčasťou bielkovín, aminokyselín, hemoglobínu atď.
Čo je užitočné: nevyhnutné pre existenciu zvierat a rastlín. V priemysle sa používa ako plynné médium na balenie a skladovanie, chladivo. S jeho pomocou sa syntetizujú rôzne zlúčeniny - amoniak, hnojivá, výbušniny, farbivá.
KYSLÍK (O)
Kde sa stretáva: Najbežnejší prvok na Zemi, tvorí asi 47 % hmotnosti pevnej zemskej kôry. Morské a sladkej vody 89% kyslíka, atmosféra - 23%.
Čo je užitočné: Vďaka kyslíku môžu živé bytosti dýchať, bez neho by oheň nebol možný. Tento plyn je široko používaný v medicíne, hutníctve, potravinárstve, energetike.
OXID UHLIČITÝ (CO2)
Kde sa stretáva: V atmosfére, v morskej vode.
Čo je užitočné: Vďaka tejto zlúčenine môžu rastliny dýchať. Proces absorpcie oxidu uhličitého zo vzduchu sa nazýva fotosyntéza. Je hlavným zdrojom biologickej energie. Stojí za to pripomenúť, že energia, ktorú získavame spaľovaním fosílnych palív (uhlie, ropa, plyn), sa milióny rokov hromadí v útrobách zeme práve vďaka fotosyntéze.
ŽELEZO (Fe)
Kde sa stretáva: jeden z najrozšírenejších prvkov v slnečnej sústave. Pozostáva z jadier terestrických planét.
Čo je užitočné: kov používaný človekom od staroveku. Celý historickej éry nazývaná doba železná. Teraz až 95 % svetovej produkcie kovov pripadá na železo, je hlavnou zložkou ocelí a liatiny.
STRIEBRO (AG)
Kde sa stretáva: Jedna z nedostatkových položiek. Predtým sa stretol v prírode v pôvodnej forme.
Čo je užitočné: Od polovice 13. storočia sa stal tradičným materiálom na výrobu jedál. Má jedinečné vlastnosti, preto sa používa v rôznych priemyselných odvetví- v šperkárstve, fotografii, elektrotechnike a elektronike. Známe sú aj dezinfekčné vlastnosti striebra.
ZLATO (Au)
Kde sa stretáva: sa predtým vyskytoval v prírode v pôvodnej forme. Vyrábané v baniach.
Čo je užitočné: najdôležitejším prvkom svetového finančného systému, pretože jeho rezervy sú malé. Už dlho sa používa ako peniaze. Všetky zlaté rezervy bánk sú v súčasnosti zhodnotené
na 32 tisíc ton - ak ich spojíte dokopy, dostanete kocku so stranou len 12 m. Používa sa v medicíne, mikroelektronike, jadrovom výskume.
SILICON (Si)
Kde sa stretáva: Z hľadiska prevalencie v zemská kôra tento prvok je na druhom mieste (27-30% z celkovej hmotnosti).
Čo je užitočné: Kremík je hlavným materiálom pre elektroniku. Používa sa aj v hutníctve a pri výrobe skla a cementu.
VODA (H2O)
Kde sa stretáva: Naša planéta je zo 71 % pokrytá vodou. Ľudské telo sa skladá zo 65% z tejto zlúčeniny. Voda je aj vo vesmíre, v telese komét.
Čo je užitočné: Má kľúčový význam pri vytváraní a udržiavaní života na Zemi, pretože vďaka svojim molekulárnym vlastnostiam je univerzálnym rozpúšťadlom. Voda má mnoho jedinečných vlastností, o ktorých neuvažujeme. Ak by teda pri zamrznutí nezväčšil svoj objem, život by jednoducho nevznikol: nádrže by každú zimu zamrzli až po dno. A tak, rozpínajúci sa, ľahší ľad zostáva na povrchu a zachováva si pod ním životaschopné prostredie.
Všetci vieme, že vodík zapĺňa náš vesmír zo 75 %. Ale viete čo ešte chemické prvky, nemenej dôležité pre našu existenciu a hrajúce významnú úlohu pre život ľudí, zvierat, rastlín a celej našej Zeme? Prvky z tohto hodnotenia tvoria celý náš vesmír!
10. Síra (prevalencia v porovnaní s kremíkom - 0,38)
Tento chemický prvok v periodickej tabuľke je uvedený pod symbolom S a je charakterizovaný atómovým číslom 16. Síra je v prírode veľmi rozšírená.
9. Železo (prevalencia v porovnaní s kremíkom - 0,6)

Označuje sa symbolom Fe, atómovým číslom - 26. Železo je v prírode veľmi bežné, najmä dôležitá úloha hrá pri tvorbe vnútorných a vonkajších obalov zemského jadra.
8. Horčík (prevalencia v porovnaní s kremíkom - 0,91)

V periodickej tabuľke sa horčík nachádza pod symbolom Mg a jeho atómové číslo je 12. Na tomto chemickom prvku je najviac prekvapujúce, že sa najčastejšie uvoľňuje pri výbuchu hviezd v procese ich premeny na supernovy.
7. Kremík (prevalencia v porovnaní s kremíkom - 1)

Označované ako Si. Atómové číslo kremíka je 14. Tento šedomodrý metaloid je v zemskej kôre vo svojej čistej forme veľmi vzácny, no v iných látkach je celkom bežný. Nachádza sa napríklad aj v rastlinách.
6. Uhlík (množstvo vzhľadom na kremík - 3,5)

Uhlík v Mendelejevovej tabuľke chemických prvkov je uvedený pod symbolom C, jeho atómové číslo je 6. Najznámejšou alotropickou modifikáciou uhlíka je jeden z najžiadanejších drahokamov na svete – diamanty. Uhlík sa aktívne používa aj na iné priemyselné účely na každodennejší účel.
5. Dusík (množstvo vzhľadom na kremík - 6,6)

Symbol N, atómové číslo 7. Ako prvý objavil škótsky lekár Daniel Rutherford, dusík sa najčastejšie vyskytuje vo forme kyselina dusičná a dusičnany.
4. Neón (množstvo vzhľadom na kremík - 8,6)

Označuje sa symbolom Ne, atómové číslo je 10. Nie je žiadnym tajomstvom, že tento konkrétny chemický prvok je spojený s krásnou žiarou.
3. Kyslík (množstvo vzhľadom na kremík - 22)

Chemický prvok so symbolom O a atómovým číslom 8, kyslík, je pre našu existenciu nevyhnutný! To ale neznamená, že je prítomný len na Zemi a slúži len pre ľudské pľúca. Vesmír je plný prekvapení.
2. Hélium (množstvo vzhľadom na kremík - 3 100)

Symbol hélia je He, atómové číslo je 2. Je bezfarebný, bez zápachu, bez chuti, netoxický a jeho bod varu je najnižší spomedzi všetkých chemických prvkov. A vďaka nemu gule stúpajú hore!
1. Vodík (množstvo vzhľadom na kremík - 40 000)

Skutočné číslo jedna v našom zozname, vodík je v periodickej tabuľke pod symbolom H a má atómové číslo 1. Je to najľahší chemický prvok. periodická tabuľka a najbežnejší prvok v celom vesmíre skúmaný človekom.
Najjednoduchší a najbežnejší prvok
Vodík má len jeden protón a jeden elektrón (je to jediný prvok bez neutrónu). Je to najjednoduchší prvok vo vesmíre, čo vysvetľuje, prečo je aj najhojnejšie, povedal Nyman. Izotop vodíka nazývaný deutérium však obsahuje jeden protón a jeden neutrón, zatiaľ čo iný, známy ako trícium, má jeden protón a dva neutróny.
Vo hviezdach sa atómy vodíka spájajú a vytvárajú hélium, druhý najrozšírenejší prvok vo vesmíre. Hélium má dva protóny, dva neutróny a dva elektróny. Hélium a vodík spolu tvoria 99,9 percenta všetkej známej hmoty vo vesmíre. 
Napriek tomu je vo vesmíre asi 10-krát viac vodíka ako hélia, hovorí Nyman. „Kyslík, ktorý je tretím najrozšírenejším prvkom, je asi 1000-krát menší ako vodík,“ dodala.
Vo všeobecnosti platí, že čím vyššie je atómové číslo prvku, tým menej ho možno vo vesmíre nájsť. 
Vodík v Zemi
Zloženie Zeme je však odlišné od zloženia vesmíru. Napríklad kyslík je hmotnostne najrozšírenejším prvkom v zemskej kôre. Nasleduje kremík, hliník a železo. V ľudskom tele je hmotnostne najrozšírenejším prvkom kyslík, po ňom nasleduje uhlík a vodík.
Úloha v ľudskom tele
Vodík má niekoľko kľúčových úloh Ľudské telo. Vodíkové väzby pomáhajú DNA zostať skrútené. Vodík navyše pomáha udržiavať správne pH v žalúdku a iných orgánoch. Ak dostane aj žalúdok alkalické prostredie, vodík sa uvoľňuje, pretože je spojený s reguláciou tohto procesu. Ak je prostredie v žalúdku príliš kyslé, vodík sa naviaže na iné prvky. 
Vodík vo vode
Okrem toho je to vodík, ktorý umožňuje ľadu plávať na povrchu vody, pretože vodíkové väzby zväčšujú vzdialenosť medzi jeho zmrazenými molekulami, čím sa stávajú menej hustými.
Hmota je zvyčajne hustejšia, keď je skôr v pevnom než kvapalnom stave, povedal Nyman. Voda je jediná látka, ktorá sa stáva menej hustou ako tuhá látka. 
Aké je nebezpečenstvo vodíka
Nebezpečný však môže byť aj vodík. Jeho reakcia s kyslíkom viedla k havárii vzducholode Hindenburg, pri ktorej v roku 1937 zahynulo 36 ľudí. okrem toho vodíkové bomby môžu byť neuveriteľne deštruktívne, hoci nikdy neboli použité ako zbraň. Napriek tomu svoj potenciál v 50. rokoch preukázali krajiny ako USA, ZSSR, Veľká Británia, Francúzsko a Čína.
Vodíkové bomby, podobne ako atómové bomby, využívajú na zničenie kombináciu jadrovej fúzie a štiepnych reakcií. Keď explodujú, vytvárajú nielen mechanické rázové vlny, ale aj žiarenie.
Na Zemi - kyslík, vo vesmíre - vodík
Vo vesmíre je najviac vodíka (74 % hmotnosti). Zachoval sa od r veľký tresk. Len nepatrná časť vodíka sa vo hviezdach dokázala premeniť na ťažšie prvky. Na Zemi je najbežnejším prvkom kyslík (46-47%). Väčšina z nich je viazaná vo forme oxidov, predovšetkým oxidu kremičitého (SiO 2 ). Zemský kyslík a kremík vznikli v masívnych hviezdach, ktoré existovali pred narodením Slnka. Na konci svojho života tieto hviezdy explodovali v supernovách a vyvrhli prvky v nich vytvorené do vesmíru. Produkty výbuchu samozrejme obsahovali veľa vodíka a hélia, ako aj uhlíka. Tieto prvky a ich zlúčeniny sú však veľmi prchavé. V blízkosti mladého Slnka sa vyparili a radiačným tlakom boli vyfúknuté na okrajové časti slnečná sústava
Desať najbežnejších prvkov v galaxii Mliečna dráha*
* Hmotnostný zlomok na milión.

Samozrejme, v našom chápaní ide o niečo ako jeden celok. Ale má svoju vlastnú štruktúru a zloženie. To zahŕňa všetky nebeských telies a predmety, hmota, energia, plyn, prach a iné. Toto všetko sa formovalo a existuje bez ohľadu na to, či to vidíme alebo cítime.
Vedci dlho zvažovali takéto otázky: Čo vytvorilo taký vesmír? A aké prvky ho napĺňajú?
Dnes si povieme, ktorý prvok je vo vesmíre najrozšírenejší.
Ukazuje sa, že tento chemický prvok je najľahší na svete. Navyše jeho monatomická forma tvorí približne 87 % celkového zloženia vesmíru. Okrem toho sa nachádza vo väčšine molekulárnych zlúčenín. Dokonca aj vo vode, alebo je napríklad súčasťou organickej hmoty. Okrem toho je vodík obzvlášť dôležitou zložkou acidobázických reakcií.
Okrem toho je prvok rozpustný vo väčšine kovov. Je zaujímavé, že vodík je bez zápachu, farby a chuti.

V procese štúdia vedci nazvali vodík horľavým plynom.
Hneď ako to nebolo definované. Kedysi niesol meno zrodenie vody a potom vodotvornej látky.
Až v roku 1824 dostal názov vodík.
Vodík tvorí 88,6 % všetkých atómov. Oddýchnite si viac tvorí hélium. A len malá časť sú ostatné prvky.
V dôsledku toho hviezdy a iné plyny obsahujú väčšinou vodík.
Mimochodom, opäť je prítomný aj pri hviezdnych teplotách. Avšak vo forme plazmy. A vo vesmíre je zastúpený vo forme molekúl, atómov a iónov. Je zaujímavé, že vodík je schopný vytvárať molekulárne oblaky.

Charakterizácia vodíka
Vodík je jedinečný prvok, pretože nemá neutrón. Obsahuje iba jeden protón a elektrón.
Ako bolo uvedené, je to najľahší plyn. Je dôležité, že čím menšia je hmotnosť molekúl, tým vyššia je ich rýchlosť. Ani teplota to neovplyvňuje.
Tepelná vodivosť vodíka je jedna z najvyšších spomedzi všetkých plynov.
Okrem iného je vysoko rozpustný v kovoch, čo ovplyvňuje jeho schopnosť difundovať cez ne. Niekedy tento proces vedie k zničeniu. Napríklad interakcia vodíka a uhlíka. V tomto prípade dochádza k dekarbonizácii.
Príchod vodíka
Vznikol vo vesmíre po Veľkom tresku. Ako všetky chemikálie. Podľa teórie bola v prvých mikrosekundách po výbuchu teplota vesmíru vyššia ako 100 miliárd stupňov. Čo vytvorilo väzbu troch kvarkov. Táto interakcia zase vytvorila protón. Tak vzniklo jadro atómu vodíka. Počas expanzie teplota klesla a kvarky tvorili protóny a neutróny. Takže v skutočnosti sa objavil vodík.

V intervale od 1 do 100 sekúnd po vzniku vesmíru sa časť protónov a neutrónov spojila. Tak vzniká ďalší prvok, hélium.
V budúcnosti expanzia priestoru a v dôsledku toho pokles teploty pozastavili spojovacie reakcie. Dôležité je, že sa znova spustili vo vnútri hviezd. Takto vznikli atómy iných chemických prvkov.
V dôsledku toho sa ukazuje, že vodík a hélium sú hlavnými motormi na tvorbu ďalších prvkov.

Hélium je vo všeobecnosti druhým najrozšírenejším prvkom vo vesmíre. Jeho podiel je 11,3 % z celkového kozmického priestoru.
vlastnosti hélia
Rovnako ako vodík je bez zápachu, farby a chuti. Navyše je to druhý najľahší plyn. Ale jeho bod varu je najnižší známy.
Hélium je inertný, netoxický a monatomický plyn. Jeho tepelná vodivosť je vysoká. Podľa tejto charakteristiky je opäť na druhom mieste po vodíku.
Výroba hélia sa uskutočňuje separáciou pri nízkej teplote.
Je zaujímavé, že hélium bolo predtým považované za kov. Ale v procese štúdia sa zistilo, že ide o plyn. Navyše hlavná časť vesmíru.

Všetky prvky na Zemi, s výnimkou vodíka a hélia, vznikli pred miliardami rokov alchýmiou hviezd, z ktorých sú dnes niekde na druhej strane nenápadní bieli trpaslíci. mliečna dráha. Dusík v našej DNA, vápnik v našich zuboch, železo v krvi, uhlík v našich jablkových koláčoch sú vytvorené v jadre zmenšujúcich sa hviezd.
Sme stvorení z hviezdnej hmoty.
Carl Sagan
Aplikácia prvkov
Ľudstvo sa naučilo získavať a využívať chemické prvky vo svoj vlastný prospech. Takže vodík a hélium sa používajú v mnohých oblastiach činnosti. Napríklad v:
- Potravinársky priemysel;
- hutníctvo;
- chemický priemysel;
- rafinácia ropy;
- výroba elektroniky;
- kozmetický priemysel;
- geológia;
- aj vo vojenskej sfére a pod.
Ako vidíte, tieto prvky hrajú dôležitú úlohu v živote vesmíru. Je zrejmé, že naša samotná existencia priamo závisí od nich. Vieme, že každú minútu dochádza k rastu a pohybu. A napriek tomu, že sú jednotlivo malé, všetko okolo je založené na týchto prvkoch.
Naozaj, vodík a hélium, ako aj iné chemické prvky, sú jedinečné a úžasné. Možno sa s tým nedá polemizovať.
"Dva najbežnejšie prvky vo vesmíre sú vodík a hlúposť." - Harlan Ellison. Po vodíku a héliu je periodická tabuľka plná prekvapení. Medzi najviac úžasné fakty je tu tiež skutočnosť, že každý materiál, ktorého sme sa kedy dotkli, videli, interagovali s ním, pozostáva z dvoch rovnakých vecí: atómové jadrá kladne nabité a záporne nabité elektróny. Spôsob, akým tieto atómy na seba vzájomne pôsobia – ako sa tlačia, viažu, priťahujú a odpudzujú, čím vytvárajú nové stabilné molekuly, ióny, stavy elektronickej energie – v skutočnosti určuje malebnosť sveta okolo nás.
Aj keď sú to kvantové a elektromagnetické vlastnosti týchto atómov a ich zložiek, ktoré umožňujú nášmu vesmíru, je dôležité pochopiť, že vôbec nezačal všetkými týmito prvkami. Naopak, začala takmer bez nich.
Vidíte, na dosiahnutie rôznych väzobných štruktúr a vytvorenie zložitých molekúl, ktoré sú základom všetkého, čo poznáme, je potrebných veľa atómov. Nie z kvantitatívneho hľadiska, ale z rôznych dôvodov, to znamená, že v ich atómových jadrách sú atómy s rôznym počtom protónov: to je to, čo robí prvky odlišnými.
Naše telo potrebuje prvky ako uhlík, dusík, kyslík, fosfor, vápnik a železo. Kôra našej Zeme potrebuje prvky ako kremík a mnohé ďalšie. ťažké prvky, zatiaľ čo jadro Zeme - aby mohlo vytvárať teplo - potrebuje prvky pravdepodobne z celej periodickej tabuľky, ktoré sa nachádzajú v prírode: tórium, rádium, urán a dokonca aj plutónium.

Ale vráťme sa do raných štádií vesmíru - pred objavením sa človeka, života, našej slnečnej sústavy, k úplne prvým pevným planétam a dokonca k prvým hviezdam - keď všetko, čo sme mali, bolo horúce, ionizované more protónov. , neutróny a elektróny. Neexistovali žiadne prvky, žiadne atómy a žiadne atómové jadrá: vesmír bol na to všetko príliš horúci. Až keď sa vesmír roztiahol a ochladil, nastala aspoň určitá stabilita.
Uplynul nejaký čas. Prvé jadrá sa spojili a znova sa neoddelili, čím sa vytvoril vodík a jeho izotopy, hélium a jeho izotopy a malé, ťažko rozlíšiteľné objemy lítia a berýlia, ktoré sa následne rádioaktívne rozpadá na lítium. Takto začal vesmír: z hľadiska počtu jadier - 92 % vodíka, 8 % hélia a približne 0,00000001 % lítia. Podľa hmotnosti - 75-76% vodíka, 24-25% hélia a 0,00000007% lítia. Na začiatku boli dve slová: vodík a hélium, to je všetko, dalo by sa povedať.
O státisíce rokov neskôr sa vesmír dostatočne ochladil na to, aby sa vytvorili neutrálne atómy a o desiatky miliónov rokov neskôr gravitačný kolaps umožnil vznik prvých hviezd. Fenomén jadrovej fúzie zároveň naplnil vesmír nielen svetlom, ale umožnil aj vznik ťažkých prvkov.
V čase, keď sa zrodila prvá hviezda, niekde medzi 50 a 100 miliónmi rokov po Veľkom tresku, sa začalo veľké množstvo vodíka spájať do hélia. Čo je však dôležitejšie, najhmotnejšie hviezdy (8-krát hmotnejšie ako naše Slnko) spálili svoje palivo veľmi rýchlo a zhoreli len za pár rokov. Len čo jadrám takýchto hviezd došiel vodík, héliové jadro sa stiahlo a začalo spájať tri jadrá atómu do uhlíka. V ranom vesmíre (ktorý vytvoril veľa) potreboval iba bilión týchto ťažkých hviezd viac hviezd v prvých niekoľkých stovkách miliónov rokov), aby bolo lítium porazené.
A tu si pravdepodobne hovoríte, že uhlík sa v dnešnej dobe stal prvkom číslo tri? Možno si to predstaviť tak, že hviezdy syntetizujú prvky vo vrstvách, napríklad cibuľa. Hélium sa syntetizuje na uhlík, uhlík na kyslík (neskôr a pri vyšších teplotách), kyslík na kremík a síru a kremík na železo. Na konci reťaze sa železo nemôže zlúčiť do ničoho iného, takže jadro exploduje a hviezda sa zmení na supernovu.

Tieto supernovy, štádiá, ktoré k nim viedli, a ich následky obohatili vesmír o obsah vonkajších vrstiev hviezdy, vodík, hélium, uhlík, kyslík, kremík a všetky ťažké prvky, ktoré vznikli počas iných procesov:
- pomalé zachytávanie neutrónov (s-proces), postupné zoraďovanie prvkov;
- fúzia jadier hélia s ťažkými prvkami (s tvorbou neónu, horčíka, argónu, vápnika atď.);
- rýchly záchyt neutrónov (r-proces) s tvorbou prvkov až po urán a ďalej.
Ale mali sme viac ako jednu generáciu hviezd: mali sme ich veľa a generácia, ktorá dnes existuje, nie je postavená primárne na panenskom vodíku a héliu, ale aj na zvyškoch predchádzajúcich generácií. Je to dôležité, pretože bez nej by sme nikdy nemali pevné planéty, iba plynné obry vyrobené výlučne z vodíka a hélia.
V priebehu miliárd rokov sa proces vzniku a zániku hviezd opakoval a stále viac sa obohacovali prvky. Namiesto fúzie vodíka na hélium, masívne hviezdy fúzujú vodík Cyklus C-N-O, čím sa časom vyrovnávajú objemy uhlíka a kyslíka (a o niečo menej dusíka).
Tiež, keď hviezdy prechádzajú fúziou hélia za vzniku uhlíka, je pomerne ľahké chytiť ďalší atóm hélia na vytvorenie kyslíka (a dokonca pridať ďalšie hélium ku kyslíku, aby sa vytvoril neón), a dokonca aj naše Slnko to urobí počas fázy červeného obra.

Ale v hviezdnych kováčňach je jeden vražedný krok, ktorý odstraňuje uhlík z kozmickej rovnice: keď sa hviezda stane dostatočne masívnou na to, aby iniciovala uhlíkovú fúziu – taká je potreba vytvorenia supernovy typu II – proces, ktorý premení plyn na kyslík zlyhá a v čase, keď je hviezda pripravená na výbuch, vytvára oveľa viac kyslíka ako uhlíka.
Keď sa pozrieme na zvyšky supernov a planetárne hmloviny - zvyšky veľmi hmotných hviezd, respektíve hviezd podobných slnku - zistíme, že kyslík v každom prípade prevyšuje hmotnosť a množstvo uhlíka. Zistili sme tiež, že žiadny z ostatných prvkov nie je ťažší ani sa nepribližuje.

Takže, vodík #1, hélium #2 - týchto prvkov je vo vesmíre veľa. Zo zostávajúcich prvkov si však kyslík drží suverénne číslo 3, nasleduje uhlík #4, neón #5, dusík #6, horčík #7, kremík #8, železo #9 a desiatku dopĺňa Wednesday.
Čo nás čaká v budúcnosti?

Počas dostatočne dlhého časového obdobia, tisíckrát (alebo miliónov) násobku súčasného veku vesmíru, sa budú ďalej formovať hviezdy, ktoré buď vychrlia palivo do medzigalaktického priestoru, alebo ho čo najviac spália. V tomto procese môže hélium konečne predbehnúť vodík v hojnosti alebo vodík zostane na prvom mieste, ak je dostatočne izolovaný od fúznych reakcií. Zapnuté veľká vzdialenosť hmota, ktorá nie je vylúčená z našej galaxie, sa môže znova a znova zlučovať, takže uhlík a kyslík obídu aj hélium. Možno prvky #3 a #4 posunú prvé dva.
Vesmír sa mení. Kyslík je tretím najrozšírenejším prvkom v modernom vesmíre a vo veľmi, veľmi vzdialenej budúcnosti sa pravdepodobne povýši nad vodík. Zakaždým, keď sa nadýchnete vzduchu a pocítite uspokojenie z tohto procesu, pamätajte: hviezdy sú jediným dôvodom existencie kyslíka.
Podľa väčšiny vedcov došlo k vzniku chemických prvkov vo vesmíre po Veľkom tresku. Zároveň sa niektoré látky tvorili viac, niektoré menej. Náš top obsahuje zoznam najbežnejších chemických prvkov na Zemi a vo vesmíre.
Vodík vedie cestu. V periodickej tabuľke je označený symbolom H a atómovým číslom 1. Objavil ho v roku 1766 G. Cavendish. A o 15 rokov neskôr ten istý vedec zistil, že vodík sa podieľa na tvorbe väčšiny látok na planéte.
Vodík je nielen najrozšírenejším, ale aj najvýbušnejším a najľahším chemickým prvkom vo vesmíre v prírode. V zemskej kôre je jeho objem 1%, ale počet atómov je 16%. Tento prvok je súčasťou mnohých prírodných zlúčenín, napríklad ropy, zemného plynu, uhlia.
Vodík sa takmer nikdy nenachádza vo voľnom stave. Na povrchu Zeme je prítomný v niektorých sopečných plynoch. Je vo vzduchu, ale vo veľmi malých dávkach. Takmer polovicu štruktúry hviezd, väčšinu medzihviezdnej sféry a plynov hmlovín zaberá vodík.

Hélium je druhým najbežnejším prvkom vo vesmíre. Je tiež považovaný za druhý najľahší. Okrem toho má hélium najnižší bod varu zo všetkých známych látok.
Objavený v roku 1868 francúzskym astronómom P. Jansenom, ktorý objavil jasne žltú čiaru v cirkumsolárnej atmosfére. A v roku 1895 anglický chemik W. Ramsay dokázal existenciu tohto prvku na Zemi.

Okrem extrémnych podmienok je hélium prítomné iba ako plyn. Vo vesmíre vznikla v prvých chvíľach po veľkom tresku. Dnes sa hélium objavuje pri termonukleárnej fúzii s vodíkom v hĺbkach hviezd. Na Zemi vzniká po rozpade ťažkých prvkov.
Najrozšírenejším prvkom v zemskej kôre (49,4 %) je kyslík. Označuje sa symbolom O a číslom 8. Nepostrádateľný pre existenciu človeka.
Kyslík je chemicky neaktívny nekov. Za štandardných podmienok je v bezfarebnom plynnom stave, bez zápachu a chuti. Molekula obsahuje dva atómy. V tekutej forme má svetlomodrý odtieň, v tuhej forme vyzerá ako kryštály s modrastým odtieňom.

Kyslík je nevyhnutný pre všetky živé bytosti na Zemi. Je zapojený do kolobehu hmoty už viac ako 3 miliardy rokov. Zohráva významnú úlohu v hospodárstve a prírode:
- Podieľa sa na fotosyntéze rastlín;
- Absorbované živými organizmami počas dýchania;
- Pôsobí ako oxidačné činidlo v procesoch fermentácie, rozkladu, hrdzavenia;
- Nachádza sa v organických molekulách;
- Nevyhnutné pre získanie cenných látok organickej syntézy.

V skvapalnenom stave sa kyslík používa na rezanie a zváranie kovov, práce v podzemí a pod vodou a akcie vo vysokej nadmorskej výške v priestore bez vzduchu. Kyslíkové vankúše sú nenahraditeľné pri vykonávaní lekárskych manipulácií.
Na 4. mieste je dusík dvojatómový bezfarebný plyn bez chuti. Existuje nielen na našej vlastnej, ale aj na niekoľkých iných planétach. Pozostáva z takmer 80 % zemskú atmosféru. Dokonca aj ľudské telo obsahuje až 3 % tohto prvku.

Okrem plynného dusíka existuje tekutý dusík. Je široko používaný v stavebníctve, priemysle, lekárske podnikanie. Používa sa na chladenie zariadení, zmrazenie organických látok, zbavenie sa bradavíc. Kvapalný dusík je nevýbušný a netoxický.
Prvok blokuje oxidáciu a rozklad. Široko používaný v baniach na vytvorenie prostredia odolného voči výbuchu. IN chemická výroba používa sa na výrobu amoniaku, hnojív, farbív a používa sa ako chladivo pri varení.
Neón je inertný, bezfarebný atómový plyn bez zápachu. Otvorili ho v roku 1989 Briti W. Ramsay a M. Travers. Odvodené zo skvapalneného vzduchu vylúčením iných prvkov.

Názov plynu sa prekladá ako „nový“. Vo vesmíre je distribuovaný extrémne nerovnomerne. Maximálna koncentrácia bola zistená na horúcich hviezdach, vo vzduchu vonkajších planét našej sústavy a v plynných hmlovinách.
Na Zemi sa neón nachádza najmä v atmosfére a v ostatných častiach je zanedbateľný. Vedci pri vysvetľovaní nedostatku neónov na našej planéte predpokladali, že kedysi Zem stratil svoju primárnu atmosféru a s ňou aj hlavný objem inertných plynov.
Uhlík je na 6. mieste v zozname najbežnejších chemických prvkov na Zemi. V periodickej tabuľke je označený písmenom C. Má mimoriadne vlastnosti. Je to hlavný biogénny prvok planéty.
Známy už od staroveku. Zahrnuté v štruktúre čierne uhlie, grafit, diamanty. Obsah v zemskej nebeskej klenbe je 0,15 %. Nie príliš vysoká koncentrácia sa vysvetľuje skutočnosťou, že uhlík v prírode neustále cirkuluje.

Existuje niekoľko minerálov obsahujúcich tento prvok:
- antracit;
- olej;
- Dolomit;
- vápenec;
- roponosná bridlica;
- Rašelina;
- Hnedé a čierne uhlie;
- Zemný plyn;
- Bitúmen.
Sklad uhlíkových skupín sú živé bytosti, rastliny a vzduch.
Kremík je nekov bežne sa vyskytujúci v zemskej kôre. Vo voľnej forme ho vyšľachtili v roku 1811 J. Tenard a J. Gay-Lussac. Obsah v planetárnom obale je 27,6-29,5% hmotnosti, v oceánskej vode - 3 mg / l.

Mnohé zlúčeniny kremíka sú známe už od staroveku. Ale čistý živel zostal dlho za hranicami ľudského poznania. Najpopulárnejšie zlúčeniny boli ozdobné a drahé kamene na báze oxidu kremičitého:
- drahokam;
- Onyx;
- opál;
- chalcedón;
- Chryzopráz atď.
V prírode sa prvok nachádza v:
- Horské masívne skaly a usadeniny;
- Rastliny a morský život;
- Hlboko v pôde;
- V organizmoch živých bytostí;
- Na dne rybníkov.

Kremík zohráva obrovskú úlohu pri formovaní ľudského tela. Každý deň by sa dovnútra malo dostať aspoň 1 gram prvku, inak sa začnú objavovať nepríjemné neduhy. To isté možno povedať o rastlinách a zvieratách.
Horčík je tvárny, ľahký kov so strieborným odtieňom. V periodickej tabuľke označenej symbolom Mg. V roku 1808 dostal Angličan G. Davy. Objemom v zemskej kôre zaberá 8. miesto. prírodné pramene sú ložiská nerastov, soľanka a morská voda.
V štandardnom stave je pokrytý vrstvou oxidu horečnatého, ktorý sa rozkladá pri teplote +600-650 0 C. Pri horení vyžaruje žiarivo biely plameň s tvorbou nitridu a oxidu.

Kovový horčík sa používa v mnohých oblastiach:
- Pri regenerácii titánu;
- Pri získavaní ľahkých odlievacích zliatin;
- Pri vytváraní zápalných a osvetľovacích rakiet.
Zliatiny horčíka sú najdôležitejším konštrukčným materiálom v dopravnom a leteckom priemysle.
Horčík sa z nejakého dôvodu nazýva „kovom života“. Bez nej je väčšina fyziologických procesov nemožná. Hrá vedúcu úlohu vo fungovaní nervového a svalového tkaniva, podieľa sa na metabolizme lipidov, bielkovín a sacharidov.
Železo je kujný, strieborno-biely kov s vysoký stupeň chemická reakcia. Označuje sa písmenami Fe. Rýchlo hrdzavie pri zvýšených teplotách/vlhkosti. Zapaľuje sa v čistenom kyslíku. Schopný spontánne vznietiť v jemne rozptýlenom vzduchu.

V každodennom živote sa železo nazýva jeho zliatinami s minimálnym množstvom prísad, ktoré si zachovávajú ťažnosť čistého kovu:
- Oceľ;
- Liatina;
- Legovaná oceľ.
Predpokladá sa, že železo tvorí hlavné percento zemského jadra. Má niekoľko úrovní oxidácie, čo je najdôležitejšia geochemická vlastnosť.
Síra zaujíma desiate miesto v zozname najbežnejších chemických prvkov na Zemi. Označené písmenom S. Vykazuje nekovové vlastnosti. Vo svojom prirodzenom stave sa javí ako svetložltý prášok s charakteristickou arómou alebo ako brilantné kryštály sklovitej žltej farby. V oblastiach starovekého a nedávneho vulkanizmu sa nachádzajú drobivé ložiská síry.

Bez síry nie je možné vykonávať mnohé priemyselné operácie:
- Uvoľňovanie prípravkov pre poľnohospodárske potreby;
- Pridanie špeciálnych vlastností niektorým druhom ocele;
- Tvorba kyseliny sírovej;
- výroba gumy;
- Výroba síranov a ďalšie.
Síra lekárska sa nachádza v kožných mastiach, používa sa na liečbu reumatizmu a dny, je súčasťou kozmetických prípravkov starostlivosti o pleť. Používa sa pri výrobe sadry, laxatív a liekov na hypertenziu.
Video