A reakciók első csoportja a szubsztitúciós reakciók. Azt mondtuk, hogy az arének nem tartalmaznak többszörös kötést a molekulaszerkezetben, hanem egy hat elektronból álló konjugált rendszert tartalmaznak, ami nagyon stabil és további erőt ad a benzolgyűrűnek. Ezért be kémiai reakciók először a hidrogénatomok kicserélődése történik, és nem a benzolgyűrű tönkremenetele.
Szubsztitúciós reakciókkal már találkoztunk az alkánokról beszélve, de náluk ezek a reakciók radikális mechanizmus szerint mentek végbe, az arénokra pedig ez a jellemző. ionos mechanizmus helyettesítési reakciók.
Első kémiai tulajdonság halogénezés. Hidrogénatom helyettesítése halogénatommal klórral vagy brómmal.
A reakció hevítéssel és mindig katalizátor részvételével megy végbe. Klór esetében lehet alumínium-klorid vagy vas-klorid három. A katalizátor polarizálja a halogén molekulát, ami heterolitikus kötés felszakad, és ionok keletkeznek.
A pozitív töltésű kloridion reakcióba lép a benzollal.
Ha a reakció brómmal megy végbe, akkor a vas-bromid három vagy az alumínium-bromid katalizátorként működik.

Fontos megjegyezni, hogy a reakció molekuláris brómmal megy végbe, nem pedig brómos vízzel. A benzol nem lép reakcióba brómos vízzel.
A benzolhomológok halogénezésének megvannak a maga sajátosságai. A toluolmolekulában a metilcsoport elősegíti a szubsztitúciót a gyűrűben, a reakcióképesség megnő, és a reakció enyhébb körülmények között, azaz már szobahőmérsékleten megy végbe.

Fontos megjegyezni, hogy a szubsztitúció mindig orto és para helyzetben történik, így izomerek keverékét kapjuk.
Második benzol tulajdonság nitrálása, nitrocsoport bevitele a benzolgyűrűbe.

Nehéz, sárgás, keserű mandula illatú folyadék képződik nitrobenzol, így a reakció minőségi lehet a benzol esetében. A nitráláshoz tömény salétromsav és kénsav nitráló keverékét használják. A reakciót melegítéssel hajtjuk végre.
Hadd emlékeztesselek arra, hogy a Konovalov-reakcióban az alkánok nitrálásához hígítsuk Salétromsav kénsav hozzáadása nélkül.
A toluol nitrálásakor, valamint a halogénezés során orto- és para-izomerek keveréke képződik.

Harmadik a benzol alkilezése halogén-alkánokkal.

Ez a reakció lehetővé teszi szénhidrogén gyök bejutását a benzolgyűrűbe, és benzolhomológok előállításának módszerének tekinthető. Katalizátorként alumínium-kloridot használnak, amely elősegíti a halogén-alkán molekula ionokká történő bomlását. Fűtést is igényel.
Negyedik tulajdonság a benzol alkénekkel való alkilezése.

Ily módon például kumolt vagy etil-benzolt nyerhetünk. Katalizátor alumínium-klorid.
2. A benzol hozzáadásának reakciói
A reakciók második csoportja az addíciós reakciók. Azt mondtuk, hogy ezek a reakciók nem jellemzőek, de igen zord körülmények között a pi-elektronfelhő pusztulása és hat szigma kötés kialakulásával lehetségesek.
Ötödik tulajdonság az általános listában hidrogénezés, hidrogén hozzáadása.
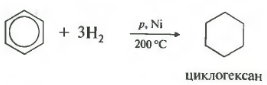
Hőmérséklet, nyomás, katalizátor nikkel vagy platina. A toluol ugyanúgy képes reagálni.
hatodik tulajdonság klórozás. Felhívjuk figyelmét, hogy kifejezetten a klórral való kölcsönhatásról beszélünk, mivel a bróm nem lép be ebbe a reakcióba.

A reakció kemény ultraibolya besugárzás alatt megy végbe. Szilárd anyag, hexaklór-ciklohexán képződik, amely a hexaklórán másik neve.
Fontos megjegyezni, hogy a benzol esetében nem lehetséges hidrogén-halogenidek addíciós reakciói (hidrohalogénezés) és víz hozzáadása (hidratálás).
3. Szubsztitúció a benzolhomológok oldalláncában
A reakciók harmadik csoportja csak a benzolhomológokat érinti – ez az oldallánc helyettesítése.
hetedik tulajdonság az általános listában halogénezés az alfa szénatomnál az oldalláncban.

A reakció hevítéskor vagy besugárzáskor megy végbe, és mindig csak az alfa-szénnél. Ahogy a halogénezés folytatódik, a második halogénatom visszatér alfa-helyzetbe.
4. A benzolhomológok oxidációja
A reakciók negyedik csoportja az oxidáció.
A benzolgyűrű túl erős, ezért benzol nem oxidálódik a kálium-permanganát nem színezi el az oldatát. Ezt nagyon fontos megjegyezni.
Másrészt a benzol homológokat kálium-permanganát megsavanyított oldatával oxidálják melegítéskor. És ez a nyolcadik kémiai tulajdonság.

Kiderül, hogy benzoesav. Az oldat elszíneződése figyelhető meg. Ilyenkor akármilyen hosszú is a szubsztituens szénlánca, az mindig az első szénatom után megszakad, és az alfa atom benzoesav képződésével karboxilcsoporttá oxidálódik. A molekula többi része a megfelelő savvá, vagy ha csak egy szénatom, akkor szén-dioxiddá oxidálódik.
Ha a benzolhomológ egynél több szénhidrogén szubsztituenst tartalmaz az aromás gyűrűn, akkor az oxidáció ugyanazon szabályok szerint megy végbe - az alfa-helyzetben lévő szén oxidálódik.

Ebben a példában egy kétbázisú aromás savat kapunk, amelyet ftálsavnak nevezünk.
Különleges módon megjegyzem a kumén, az izopropil-benzol oxidációját légköri oxigénnel kénsav jelenlétében.

Ez az úgynevezett kumén módszer a fenol előállítására. Általában ezzel a reakcióval kell foglalkozni a fenoltermeléssel kapcsolatos kérdésekben. Ez az ipari módszer.
kilencedik tulajdonság égés, teljes oxidáció oxigénnel. A benzol és homológjai szén-dioxiddá és vízzé égnek.
Írjuk fel a benzol égésének egyenletét általános formában.
A tömegmegmaradás törvénye szerint a bal oldalon annyi atom legyen, ahány atom van a jobb oldalon. Mert végül is a kémiai reakciókban az atomok nem mennek sehova, hanem egyszerűen megváltozik a köztük lévő kötések sorrendje. Tehát annyi szén-dioxid molekula lesz, ahány szénatom egy arénmolekulában, mivel a molekula egy szénatomot tartalmaz. Ez n CO 2 molekula. Feleannyi vízmolekula lesz, mint hidrogénatom, azaz (2n-6) / 2, ami n-3-at jelent.
A bal és a jobb oldalon ugyanannyi oxigénatom található. A jobb oldalon a szén-dioxidból 2n van, mert minden molekulában két oxigénatom van, plusz n-3 vízből, összesen 3n-3. A bal oldalon ugyanannyi oxigénatom található 3n-3, ami azt jelenti, hogy kétszer kevesebb molekula van, mivel a molekula két atomot tartalmaz. Azaz (3n-3)/2 oxigénmolekula.
Így összeállítottuk a benzolhomológok égésének egyenletét általános formában.
Az arének olyan aromás szénhidrogének, amelyek egy vagy több benzolgyűrűt tartalmaznak. A benzolgyűrű 6 szénatomból áll, amelyek között kettős és egyszeres kötések váltakoznak.
Fontos megjegyezni, hogy a benzolmolekulában a kettős kötések nem rögzülnek, hanem folyamatosan körben mozognak.
Az aréneket aromás szénhidrogéneknek is nevezik. A homológ sorozat első tagja a benzol - C 6 H 6 . Homológ sorozatuk általános képlete a C n H 2n-6.
Hosszú ideje szerkezeti képlet a benzol rejtély maradt. A Kekule által javasolt képlet két hármas kötéssel nem tudta megmagyarázni azt a tényt, hogy a benzol nem lép be addíciós reakciókba. Mint fentebb említettük, a modern elképzelések szerint a molekulában lévő kettős kötések folyamatosan mozognak, ezért helyesebb gyűrű formájában megrajzolni őket.
A kettős kötések konjugációt képeznek a benzolmolekulában. Minden szénatom sp 2 hibridizációs állapotban van. Vegyértékszög - 120°.
Az arének nómenklatúrája és izomériája
Az arének nevei úgy jönnek létre, hogy a szubsztituensek nevét hozzáadják a fő lánchoz - a benzolgyűrűhöz: benzol, metilbenzol (toluol), etilbenzol, propilbenzol stb. A helyettesítők a szokásos módon ábécé sorrendben vannak felsorolva. Ha a benzolgyűrűben több szubsztituens van, akkor a közöttük lévő legrövidebb utat választjuk.

Az aréneket a szubsztituensek helyzetéhez kapcsolódó szerkezeti izoméria jellemzi. Például egy benzolgyűrű két szubsztituense különböző helyzetben lehet.
A benzolgyűrűben lévő szubsztituensek helyzetének elnevezése az egymáshoz viszonyított elhelyezkedésük alapján alakul ki. Az orto-, meta- és para előtagokkal jelöljük. Alább találsz mnemonikus tippeket a sikeres memorizálásukhoz;)

Arénák megszerzése
Az arénákat többféleképpen lehet megszerezni:

Az arének kémiai tulajdonságai
Az arének olyan aromás szénhidrogének, amelyek benzolgyűrűt tartalmaznak konjugált kettős kötésekkel. Ez a funkció megnehezíti az összeadási reakciókat (de még mindig lehetséges!)
Ne feledje, hogy más telítetlen vegyületekkel ellentétben a benzol és homológjai nem színezik el a brómos vizet és a kálium-permanganát oldatot.

© Bellevich Jurij Szergejevics 2018-2020
Ezt a cikket Jurij Szergejevics Bellevics írta, és az ő szellemi tulajdonát képezi. Az információk és tárgyak másolása, terjesztése (beleértve a más oldalakra és internetes forrásokra történő másolást is) vagy bármilyen más felhasználása a szerzői jog tulajdonosának előzetes engedélye nélkül törvényileg büntetendő. A cikk anyagainak beszerzéséhez és felhasználásuk engedélyéhez vegye fel a kapcsolatot
   |
|
| Szisztematikus Név | benzol |
| Rövidítések | PhH |
| Hagyományos nevek | hajszárító (Laurent, 1837), fenil-hidrogén, benzol |
| Chem. képlet | C₆H₆ |
| Állapot | folyékony |
| Moláris tömeg | 78,11 g/mol |
| Sűrűség | 0,8786 g/cm³ |
| Dinamikus viszkozitás | 0,0652 Pa s |
| Ionizációs energia | 9,24 ± 0,01 eV |
| T. olvad. | 5,5° |
| T. kip. | 80,1° |
| T. rev. | -11° |
| T. svsp. | 562° |
| Stb. robbanás | 1,2 ± 0,1 térfogat% |
| Gőznyomás | 75 ± 1 Hgmm |
| vízben oldhatóság | 0,073 g/100 ml |
| GOST | GOST 5955-75 |
| Reg. CAS szám | 71-43-2 |
| PubChem | 241 |
| Reg. EINECS szám | 200-753-7 |
| MOSOLYOK | C1=CC=CC=C1 |
| InChI | |
| RTECS | 1400000 CY |
| CHEBI | 16716 |
| ChemSpider | 236 |
| Toxicitás | mérgező, rákkeltő és narkotikus tulajdonságokkal rendelkezik |
| jelző szó | VESZÉLYES! |
| Az adatok standard körülményekre vonatkoznak (25°, 100 kPa), hacsak nincs másképp jelezve. | |
Kémiai tulajdonságok
A szubsztitúciós reakciók jellemzőek a benzolra - a benzol reagál alkénekkel, klór-alkánokkal, halogénekkel, salétrom- és kénsavval. A benzolgyűrű hasítási reakciói zord körülmények között (hőmérséklet, nyomás) játszódnak le.
- Alkénekkel való kölcsönhatás (alkilezés), a reakció eredményeként benzol homológok képződnek, például etil-benzol és kumol:
- Klórral és brómmal való kölcsönhatás katalizátor jelenlétében klór-benzol képzésére (elektrofil szubsztitúciós reakció):
- Katalizátor hiányában fűtött vagy meggyújtott állapotban radikális reakció hozzáadásával hexaklór-ciklohexán izomerek keverékét kapjuk
- Amikor a benzol óleumoldatban brómmal reagál, hexabróm-benzol képződik:
- Kölcsönhatás alkánok halogén származékaival (benzol alkilezés, Friedel-Crafts reakció) alkilbenzolok képzése során:

- A benzol-anhidridek, karbonsav-halogenidek Friedel-Crafts acilezési reakciója aromás és zsíros aromás ketonok képződéséhez vezet:

6 6 + 6 5 COCl → AlCl 3 6 5 COC 6 5 + HCl
Az első és a második reakcióban acetofenon (metil-fenil-keton) képződik, az alumínium-klorid antimon-kloriddal történő helyettesítése lehetővé teszi a reakció hőmérsékletének 25 °C-ra történő csökkentését. A harmadik reakcióban benzofenon (difenil-keton) képződik.
- A formilezési reakció - a benzol kölcsönhatása CO és HCl keverékével, nagy nyomáson és katalizátor hatására a reakciótermék benzaldehid:
- Szulfonálási és nitrálási reakciók (elektrofil szubsztitúció):
- Benzol redukciója hidrogénnel (katalitikus hidrogénezés):
Oxidációs reakciók
A benzol szerkezetének köszönhetően nagyon ellenáll az oxidációnak, nem befolyásolja például a kálium-permanganát oldat. A maleinsavanhidriddé való oxidáció azonban végrehajtható vanádium-oxid katalizátor használatával:

- ozonolízis reakció. Ezenkívül a benzol ozonolízisen megy keresztül, de a folyamat lassabb, mint a telítetlen szénhidrogéneknél:

A reakció eredményeként dialdehid-glioxál (1,2-etándiál) képződik.
- égési reakció. A benzol égése az oxidáció korlátozó esete. A benzol nagyon gyúlékony és a levegőben nagyon füstös lánggal ég:
Szerkezet
A benzol telítetlen szénhidrogénnek minősül ( homológ sorozat n 2n−6), de az etilén sorozatú szénhidrogénekkel ellentétben a 2 4 a telítetlen szénhidrogénekben rejlő tulajdonságokat mutat (addíciós reakciók jellemzik őket), csak zord körülmények között, de a benzol hajlamosabb a szubsztitúciós reakciókra. A benzolnak ezt a "viselkedését" a speciális szerkezete magyarázza: az atomok ugyanabban a síkban való jelenléte és a konjugált 6π-elektronfelhő jelenléte a szerkezetben. A benzolban lévő kötések elektronikus természetének modern elképzelése Linus Pauling hipotézisén alapul, aki azt javasolta, hogy a benzolmolekulát hatszögként ábrázolják egy beírt körrel, ezzel is hangsúlyozva a rögzített kettős kötések hiányát és a kettős kötés jelenlétét. egyetlen elektronfelhő, amely a ciklus mind a hat szénatomját lefedi.
A szak- és populáris irodalomban a kifejezés benzolgyűrű, amely általában a benzol szénszerkezetére utal anélkül, hogy figyelembe venné a szénatomokhoz kapcsolódó egyéb atomokat és csoportokat. A benzolgyűrű számos különböző vegyület része.
Termelés
A mai napig számos, alapvetően eltérő módszer létezik a benzol előállítására.

Alkalmazás

A benzol vasúti szállítása speciális tartálykocsikban történik
A keletkező benzol jelentős részét más termékek szintézisére használják fel:
- a benzol körülbelül 50%-a etil-benzollá alakul (a benzol alkilezése etilénnel);
- a benzol kb. 25%-a kumolná alakul (a benzol alkilezése propilénnel);
- a benzol körülbelül 10-15%-át hidrogénezzük ciklohexánná;
- a benzol körülbelül 10%-át nitrobenzol előállítására fordítják;
- a benzol 2-3%-a lineáris alkilbenzolokká alakul;
- a benzol körülbelül 1%-át használják fel a klórbenzol szintéziséhez.
Sokkal kisebb mennyiségben a benzolt néhány más vegyület szintézisére használják. Alkalmanként és szélsőséges esetekben nagy toxicitása miatt benzolt használnak oldószerként.
Ezenkívül a benzol a benzin része. Az 1920-as és 1930-as években a benzolt ru de hozzáadták az egyenes lefúvatású benzinhez, hogy növeljék annak oktánszámát, de az 1940-es évekre az ilyen keverékek már nem tudtak versenyezni a magas oktánszámú benzinekkel. A magas toxicitás miatt az üzemanyag benzoltartalmát a modern szabványok legfeljebb 1%-ra korlátozzák.
Biológiai hatás és toxikológia
A benzol az egyik leggyakoribb antropogén xenobiotikum.
A benzol erősen mérgező. A minimális halálos dózis orális adagolás esetén 15 ml, az átlag 50-70 ml. A benzolgőz rövid belélegzése esetén nem következik be azonnali mérgezés, ezért egészen a közelmúltig a benzollal végzett munka eljárását nem szabályozták különösebben. Nagy adagokban a benzol hányingert és szédülést okoz, és egyes súlyos esetekben a mérgezés végzetes is lehet. A benzolmérgezés első jele gyakran az eufória. A benzolgőz áthatolhat az érintetlen bőrön. A folyékony benzol meglehetősen irritálja a bőrt. Ha az emberi szervezet kis mennyiségben hosszú távú benzolnak van kitéve, a következmények is nagyon súlyosak lehetnek.
A benzol erős rákkeltő anyag. Tanulmányok kimutatták, hogy a benzol összefüggésbe hozható olyan betegségekkel, mint az aplasztikus anémia, akut leukémia (mieloid, limfoblaszt), krónikus mieloid leukémia, mielodiszpláziás szindróma és csontvelő-betegségek.
A benzol átalakulási mechanizmusa és mutagén hatása
A benzol emberi szervezetben történő átalakulásának mechanizmusának számos változata létezik. Az első változatban a benzolmolekulát a mikroszomális oxidációs rendszer hidroxilezi citokróm P450 részvételével. A mechanizmus szerint a benzol először nagyon reaktív epoxiddá oxidálódik, amely tovább alakul fenollá. Ezenkívül szabad gyökök (reaktív oxigénfajták) keletkeznek a P450 magas aktiválódása miatt a reakció szerint:
A benzol mutagenezis molekuláris mechanizmusa
A benzol az promutagén, csak biotranszformáció után tesz szert mutagén tulajdonságokra, melynek eredményeként erősen reaktív vegyületek képződnek. Ezek egyike a benzol-epoxid. Az epoxiciklus nagy szögfeszültsége miatt a -C-O-C- kötések megszakadnak és a molekula elektrofillé válik, könnyen reagál a nukleofil centrumokkal nitrogéntartalmú bázisok molekulák nukleinsavak különösen a DNS.
Az epoxiciklus nukleofil központokkal - nitrogéntartalmú bázisok aminocsoportjaival való kölcsönhatás mechanizmusa (arilezési reakció) nukleofil szubsztitúciós reakcióként megy végbe. 2 . Ennek eredményeként meglehetősen erős kovalens kötésű DNS-adduktok képződnek, leggyakrabban ilyen származékok figyelhetők meg a guaninban (mivel a guaninmolekulában van a legtöbb nukleofil centrum), például N7-fenilguanin. A keletkező DNS-adduktumok a DNS natív szerkezetének megváltozásához vezethetnek, ezáltal megzavarhatják a transzkripció és a replikáció megfelelő lefolyását. Mi a genetikai mutációk forrása. Az epoxid felhalmozódása a májsejtekben (májsejtekben) visszafordíthatatlan következményekkel jár: fokozódik a DNS arilációja, és ezzel egyidejűleg a mutáns fehérjék expressziója (túlexpressziója) fokozódik, amelyek genetikai mutáció termékei; az apoptózis gátlása; sejttranszformáció, sőt halál. A kifejezett genotoxicitás és mutagenitás mellett a benzol erős mielotoxicitással és karcinogén hatással is rendelkezik, különösen ez a hatás a mieloid szövet sejtjeiben nyilvánul meg (e szövet sejtjei nagyon érzékenyek az ilyen típusú xenobiotikus hatásokra).
Benzol és szerhasználat
A benzol kábító hatással van az emberre, és kábítószer-függőséghez vezethet.
Akut mérgezés
Nagyon magas koncentrációban - szinte azonnali eszméletvesztés és néhány percen belüli halál. Az arc színe cianotikus, a nyálkahártya gyakran cseresznyevörös. Alacsonyabb koncentrációban - az alkoholhoz hasonló izgalom, majd álmosság, általános gyengeség, szédülés, hányinger, hányás, fejfájás, eszméletvesztés. Izomrángásokat is megfigyelnek, amelyek tónusos görcsökké válhatnak. A pupillák gyakran kitágultak és nem reagálnak a fényre. A légzés először felgyorsul, majd lelassul. A testhőmérséklet élesen csökken. Felgyorsult pulzus, kis töltet. A vérnyomás csökken. Súlyos szívritmuszavarok eseteiről számoltak be.
Súlyos, közvetlenül nem halálhoz vezető mérgezést követően időnként hosszan tartó egészségügyi rendellenességek figyelhetők meg: mellhártyagyulladás, felső légúti hurutok, szaruhártya- és retinabetegségek, májkárosodás, szívbetegségek stb. Vazomotoros eset. neurózis az arc és a végtagok duzzanatával, érzékenységi zavarokkal és görcsökkel röviddel akut benzolgőz-mérgezés után. Néha a halál egy idő után a mérgezés után következik be.
krónikus mérgezés
Súlyos esetekben: fejfájás, erős fáradtság, légszomj, szédülés, gyengeség, idegesség, álmosság vagy álmatlanság, emésztési zavarok, hányinger, néha hányás, étvágytalanság, fokozott vizeletürítés, menstruáció, gyakran tartós vérzés alakul ki a szájnyálkahártyából. , különösen az íny , és az orr, órákig, sőt napokig tart. Néha tartós vérzés lép fel a foghúzás után. Számos kis vérzés (vérzés) a bőrben. Vér a székletben, méhvérzés, retinavérzés. Általában a vérzés, és gyakran a kísérő láz (40 °C-ig és afölötti hőmérséklet) az, ami miatt a mérgezett kórházba kerül. Ilyen esetekben a prognózis mindig komoly. A halál oka olykor másodlagos fertőzések: előfordulnak periosteum gangrén gyulladása és állkapocs nekrózisa, súlyos fekélyes ínygyulladás, általános szepszis szeptikus endometritissel.
Néha súlyos mérgezés esetén idegbetegségek tünetei alakulnak ki: fokozott ínreflexek, kétoldali klónusz, pozitív Babinsky-tünet, mélyérzékenységi rendellenesség, pszeudo-tabetikus rendellenességek paresztéziával, ataxia, paraplégia és motoros rendellenességek (a hátsó oszlopok károsodásának jelei). gerincvelőés piramis pályák).
A legjellemzőbb változások a vérben. Az eritrociták száma általában élesen csökken, 1-2 millióra és az alá. A hemoglobin tartalma is meredeken csökken, néha akár 10%-ot is. A színindex egyes esetekben alacsony, néha a normálhoz közeli, néha pedig magas (különösen súlyos vérszegénység esetén). Anizocitózis és poikilocitózis, bazofil szúrás és nukleáris eritrociták megjelenése, a retikulociták számának és az eritrociták térfogatának növekedése figyelhető meg. Jellemzőbb a leukociták számának éles csökkenése. Néha kezdetben leukocitózis, gyorsan felváltja a leukopenia, az ESR felgyorsulása. A vérben bekövetkező változások nem egyidejűleg alakulnak ki. Leggyakrabban korábban a leukopoetikus rendszer érintett, később thrombocytopenia csatlakozik. Az eritroblaszt funkció veresége gyakran még később következik be. A jövőben kialakulhat a súlyos mérgezés jellegzetes képe - aplasztikus anémia.
A mérgezés hatásai a benzollal végzett munka leállítása után hónapokkal és évekkel is fennmaradhatnak, sőt előrehaladhatnak.
Elsősegély mérgezés és kezelés esetén
Nál nél akut mérgezés benzol (benzolgőz), az áldozatot először friss levegőre kell vinni, légzésleállás esetén mesterséges lélegeztetést végeznek a normalizálásra, légzésserkentőként oxigént és lobelint használnak. Az adrenalin analeptikumként való használata szigorúan tilos! Hányás esetén intravénásan 40%-os glükóz oldat, keringési zavarok esetén koffeinoldat injekciója. Ha a mérgezés szájon át történt, és a benzol a gyomorba került, növényi olajjal le kell öblíteni (a benzol jól felszívódik), az eljárást óvatosan kell elvégezni, mivel aspiráció lehetséges. Enyhe mérgezés esetén a beteg nyugalmat mutat. Izgatott állapotban nyugtatókra van szükség. Vérszegénység esetén vérátömlesztést, B12-vitamint, folsavat, leukopenia esetén B6-vitamint, pentoxilt kell adni. Az immunitás csökkenése (immunhiányos állapot) esetén - immunstimulánsok.
A benzol hatása a biomembránokra
A biológiai membránok szupramolekuláris struktúrák - kettős lipidréteg, amelybe fehérjék és poliszacharidok molekulái integrálódnak (beágyazódnak) vagy a felszínen rögzítődnek. A biomembránokat felépítő lipidek természetüknél fogva amfifil (amofil) vegyületek, vagyis a bennük lévő poláris csoportok jelenléte miatt poláris és nem poláris anyagokban is képesek oldódni, az ún. "fej"(karbonsav -COOH, hidroxil -OH, aminocsoportok -NH 2 és mások) és a nem poláris ún. "frakk"(szénhidrogén gyökök - alkilek, arilok, policiklusos szerkezetek, például kolesztán és mások).
A benzol a biológiai membránok hatékony szolubilizálója, gyorsan oldja a nem poláris csoportokat (az ún. "frakk") lipidek, főleg koleszterin, amely a membránok része. Az oldódási folyamatot a benzol koncentrációja korlátozza, minél több, annál gyorsabban megy végbe a folyamat. A szolubilizáció során energia szabadul fel, szó szerint megtörve a kettős lipidréteget (lipid kettős réteg), ami a membrán teljes pusztulásához (szerkezeti tönkremeneteléhez), majd sejtapoptózishoz vezet (a biomembránok pusztulása során a membránreceptorok aktiválódnak (pl. mint: CD95, TNFR1, DR3, DR4 és mások), amelyek aktiválják a sejt apoptózist).
Hatás a bőrön
A kéz benzollal való gyakori érintkezése esetén száraz bőr, repedések, viszketés, bőrpír (általában az ujjak között), duzzanat, kölesszerű buborékos kiütések figyelhetők meg. Néha bőrelváltozások miatt a dolgozók kénytelenek felmondani a munkájukat.
A megengedett legnagyobb koncentráció 5 mg/m 3.
Biztonság
A benzollal végzett munka mérgezés és súlyos egészségügyi problémák kockázatával jár. A benzol erősen illékony folyadék (illékonysága 320 mg/l 20°C-on) magas fok gyulladás, ezért a vele végzett munka során be kell tartani a gyúlékony folyadékokkal való munkavégzésre vonatkozó biztonsági óvintézkedéseket. A benzolgőzök nagy veszélyt jelentenek, mivel a levegővel robbanásveszélyes keveréket képezhetnek. Jelenleg a benzol szerves oldószerként való felhasználása nagyon korlátozott a gőzei mérgező és rákkeltő hatásai miatt. negatív hatás a bőrön. A laboratóriumi benzollal végzett munka szintén korlátozza (szigorúan szabályozva). Kísérletekben benzolt csak kis mennyiségben (legfeljebb 50 ml-ben) javasolt használni, a munkát kizárólag fluorelasztomerből készült kesztyűben szabad végezni (a latex benzol hatására feloldódik és megduzzad).
- hőforrások, nyílt láng, erős oxidálószerek, élelmiszerek stb. közelében tárolja,
- a benzolt tartalmazó edényeket nyitva hagyni, füstölni,
- használjon benzolos tartályt élelmiszerekhez, kézmosáshoz, mosogatáshoz,
- zárt, rosszul szellőző helyiségben, ahol a levegő hőmérséklete meghaladja a 30 ° C-ot,
- nagy mennyiségű anyagot használjon oldószerként,
- a kéz, a szem és a légzőszervek bőrének védőfelszerelése nélkül dolgozzon.
Ökológia
A benzol környezetre nem biztonságos anyag, antropogén eredetű mérgező anyag. A benzol fő forrásai a környezet co szennyvíz vagy a levegőbe történő kibocsátás a petrolkémiai és kokszipar, az üzemanyag-termelés és a szállítás. A tározókból a benzol könnyen elpárolog, talajból növényké alakulhat át, ami komoly veszélyt jelent az ökoszisztémákra.
A benzol kumuláló tulajdonsággal rendelkezik, lipofil volta miatt képes lerakódni az állatok zsírszövetének sejtjeiben, ezáltal megmérgezi azokat.
Aromás HC-k (arénák) olyan szénhidrogének, amelyek molekulái egy vagy több benzolgyűrűt tartalmaznak.
Példák aromás szénhidrogénekre:

Benzol sorarénák (monociklikus arénák)
Általános képlet:C n H 2n-6, n≥6
Az aromás szénhidrogének legegyszerűbb képviselője a benzol, tapasztalati képlete C 6 H 6 .
A benzolmolekula elektronszerkezete
A C n H 2 n -6 monociklusos arének általános képlete azt mutatja, hogy telítetlen vegyületek.
1856-ban a német kémikus A.F. Kekule ciklikus képletet javasolt a konjugált kötéseket tartalmazó benzolra (egyes és kettős kötések váltakoznak) - ciklohexatrién-1,3,5: 
A benzolmolekulának ez a szerkezete nem magyarázza meg a benzol számos tulajdonságát:
- benzolra a szubsztitúciós reakciók a jellemzőek, nem pedig a telítetlen vegyületekre jellemző addíciós reakciók. Addíciós reakciók lehetségesek, de ezek nehezebbek, mint a;
- a benzol nem lép be olyan reakciókba, amelyek minőségi reakciók telítetlen szénhidrogénekkel (brómos vízzel és KMnO 4 oldattal).
A később elvégzett elektrondiffrakciós vizsgálatok kimutatták, hogy egy benzolmolekulában a szénatomok közötti összes kötés azonos 0,140 nm hosszúságú (egy egyszerű kötés hossza közötti átlagos érték). C-C csatlakozások 0,154 nm és C=C kettős kötés 0,134 nm). Az egyes szénatomoknál a kötések közötti szög 120°. A molekula szabályos lapos hatszög.
A modern elmélet a C 6 H 6 molekula szerkezetének magyarázatára az atomi pályák hibridizációjának fogalmát használja.
A benzolban lévő szénatomok sp 2 hibridizációs állapotban vannak. Minden "C" atom három σ-kötést képez (kettőt szénatommal és egyet hidrogénatommal). Minden σ-kötés ugyanabban a síkban van:
Minden szénatomnak van egy p-elektronja, amely nem vesz részt a hibridizációban. A szénatomok nem hibridizált p-pályái a σ-kötések síkjára merőleges síkban helyezkednek el. Minden p-felhő átfedésben van két szomszédos p-felhővel, és ennek eredményeként egyetlen konjugált π-rendszer jön létre (emlékezzünk a p-elektronok konjugációjának hatására az 1,3-butadién molekulában, amelyet a „Dién szénhidrogének” című témakörben tárgyalunk ”):
Hat σ-kötés kombinációját egyetlen π-rendszerrel nevezzük aromás kötés.
A hat szénatomból álló, aromás kötéssel összekapcsolt gyűrűt nevezzük benzol gyűrű, vagy benzol atommag.
A modern elképzeléseknek megfelelően kb elektronikus szerkezet benzol, a C 6 H 6 molekula a következőképpen van ábrázolva:

A benzol fizikai tulajdonságai
Benzol at normál körülmények között- színtelen folyadék; t o pl = 5,5 o C; t o kip. = 80 körülbelül C; jellegzetes szaga van; vízzel nem elegyedő, jó oldószer, erősen mérgező.
A benzol kémiai tulajdonságai
Az aromás kötés határozza meg Kémiai tulajdonságok benzol és más aromás szénhidrogének.
A 6π-elektronos rendszer stabilabb, mint a hagyományos kételektronos π-kötések. Ezért az addíciós reakciók kevésbé jellemzőek az aromás szénhidrogénekre, mint a telítetlen szénhidrogénekre. Az arénekre a legjellemzőbbek a szubsztitúciós reakciók.
én. Szubsztitúciós reakciók
1.Halogénezés

2. Nitrálás
A reakciót és savak keverékével (nitráló keverék) hajtjuk végre: 
3. Szulfonálás

4. Alkilezés (a "H" atom helyettesítése alkilcsoporttal) - Friedel-Crafts reakciók A benzol homológjai képződnek:

A halogén-alkánok helyett alkének is használhatók (katalizátor - AlCl 3 vagy szervetlen sav jelenlétében):

II. Addíciós reakciók
1. Hidrogénezés

2. Klór hozzáadása

III.Oxidációs reakciók
1. Égés
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O
2. Nem teljes oxidáció (KMnO 4 vagy K 2 Cr 2 O 7 savas környezetben). A benzolgyűrű ellenáll az oxidálószereknek. A reakció nem következik be.
Benzol beszerzése
Az iparban:
1) olaj- és szénfeldolgozás;
2) ciklohexán dehidrogénezése:

3) hexán dehidrociklizálása (aromatizálása):

A laboratóriumban:
A benzoesav sóinak fúziója:

A benzolhomológok izomerizmusa és nómenklatúrája
Minden benzolhomológnak van oldallánca, pl. a benzolgyűrűhöz kapcsolódó alkilcsoportok. A benzol első homológja egy benzolmag, amely egy metilcsoporthoz kapcsolódik: 
A toluolnak nincsenek izomerjei, mivel a benzolgyűrű minden pozíciója egyenértékű.
A benzol későbbi homológjaihoz egyfajta izoméria lehetséges - oldallánc izoméria, amely kétféle lehet:
1) a szubsztituensek számának és szerkezetének izomériája;
2) a szubsztituensek helyzetének izomériája.



A toluol fizikai tulajdonságai
Toluol- színtelen, jellegzetes szagú folyadék, vízben nem oldódik, szerves oldószerekben oldódik. A toluol kevésbé mérgező, mint a benzol.
A toluol kémiai tulajdonságai
én. Szubsztitúciós reakciók
1. A benzolgyűrűt érintő reakciók
A metil-benzol minden olyan szubsztitúciós reakcióba bekapcsolódik, amelyben benzol vesz részt, ugyanakkor nagyobb reaktivitást mutat, a reakciók gyorsabban mennek végbe.
A toluolmolekulában lévő metilcsoport a nemzetség szubsztituense, ezért a benzolmagban végbemenő szubsztitúciós reakciók eredményeként a toluol orto- és para-származékai, illetve a reagens feleslegével tri-származékok keletkeznek. az általános képletből:

a) halogénezés


További klórozással diklór-metil-benzol és triklór-metil-benzol állítható elő:

II. Addíciós reakciók
hidrogénezés

III.Oxidációs reakciók
1. Égés
C 6 H 5 CH 3 + 9O 2 → 7CO 2 + 4H 2 O
2. Nem teljes oxidáció
A benzollal ellentétben homológjait egyes oxidálószerek oxidálják; ebben az esetben az oldallánc oxidáción megy keresztül, a toluol esetében a metilcsoport. Az enyhe oxidálószerek, mint a MnO 2, aldehid csoporttá oxidálják, az erősebb oxidálószerek (KMnO 4) pedig további savvá oxidációt okoznak: 
Az egyik oldalláncú benzol bármely homológja erős oxidálószerrel, például KMnO4-dal oxidálódik benzoesavvá, azaz benzoesavvá. az oldallánc megszakad, a leszakadt része CO 2 -dá oxidálódik; Például: 
Több oldallánc jelenlétében mindegyik karboxilcsoporttá oxidálódik, és ennek eredményeként többbázisú savak képződnek, például:

Toluol beszerzése:
Az iparban:
1) olaj- és szénfeldolgozás;
2) metil-ciklohexán dehidrogénezése:

3) a heptán dehidrociklizálása:
A laboratóriumban:
1) Friedel-Crafts alkilezés;
2) Wurtz-Fittig reakció(nátrium reakciója halogén-benzol és halogén-alkán keverékével).
Fizikai tulajdonságok
A benzol és legközelebbi homológjai színtelen, sajátos szagú folyadékok. Az aromás szénhidrogének könnyebbek, mint a víz, és nem oldódnak benne, de könnyen oldódnak szerves oldószerekben - alkoholban, éterben, acetonban.
A benzol és homológjai maguk is sokak számára jó oldószerek szerves anyag. Minden aréna füstös lánggal ég a molekuláiban található magas széntartalom miatt.
Néhány arén fizikai tulajdonságait a táblázat mutatja be.
Asztal. Egyes arénák fizikai tulajdonságai
|
Név |
Képlet |
t°.pl., |
t°.bp., |
|
Benzol |
C 6 H 6 |
5,5 |
80,1 |
|
Toluol (metil-benzol) |
C 6 H 5 CH 3 |
95,0 |
110,6 |
|
Etilbenzol |
C 6 H 5 C 2 H 5 |
95,0 |
136,2 |
|
Xilol (dimetil-benzol) |
C6H4(CH3)2 |
||
|
orto- |
25,18 |
144,41 |
|
|
meta- |
47,87 |
139,10 |
|
|
pár- |
13,26 |
138,35 |
|
|
Propilbenzol |
C6H5(CH2)2CH3 |
99,0 |
159,20 |
|
kumol (izopropil-benzol) |
C6H5CH(CH3)2 |
96,0 |
152,39 |
|
Sztirol (vinilbenzol) |
C 6 H 5 CH \u003d CH 2 |
30,6 |
145,2 |
Benzol - alacsony forráspontú ( tkip= 80,1°C), színtelen folyadék, vízben oldhatatlan
Figyelem! Benzol - méreg, a vesére hat, megváltoztatja a vérképletet (hosszabb ideig tartó expozíció esetén), megzavarhatja a kromoszómák szerkezetét.
A legtöbb aromás szénhidrogén életveszélyes és mérgező.
Arének kinyerése (benzol és homológjai)
A laboratóriumban
1. Benzoesav sóinak fúziója szilárd lúgokkal
C 6 H 5 -COONa + NaOH t → C 6 H 6 + Na 2 CO 3
nátrium benzoát
2. Wurtz-Fitting reakció: (itt G halogén)
6-tólH 5 -G+2Na + R-G →C 6 H 5 - R + 2 NaG
VAL VEL 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
Az iparban
- olajból és szénből frakcionált desztillációval, reformálással elkülönítve;
- kőszénkátrányból és kokszolókemence gázból
1. Alkánok dehidrociklizálása 6-nál több szénatommal:
C6H14 t , kat→C6H6+4H2
2. Az acetilén trimerizálása(csak benzolhoz) – R. Zelinsky:
3C 2 H2 600°C, Törvény. szén→C 6 H 6
3. Dehidrogénezés ciklohexán és homológjai:
Nyikolaj Dmitrijevics Zelinszkij szovjet akadémikus megállapította, hogy a benzol ciklohexánból (cikloalkánok dehidrogénezése) keletkezik.
C6H12 t, kat→C6H6+3H2

C6H11-CH3 t , kat→C6H5-CH3+3H2
metil-ciklohexántoluol
4. A benzol alkilezése(benzol homológjainak beszerzése) – r Friedel-Crafts.
C6H6 + C2H5-Cl t, AlCl3→C 6 H 5 - C 2 H 5 + HCl
klór-etán etil-benzol

Az arének kémiai tulajdonságai
én. OXIDÁCIÓS REAKCIÓK
1. Égés (füstös láng):
2C 6 H 6 + 15O 2 t→12CO 2 + 6H 2 O + Q
2. A benzol normál körülmények között nem színteleníti el a brómos vizet és vizes oldat kálium-permanganát
3. A benzol homológokat kálium-permanganát oxidálja (elszíneződik a kálium-permanganát):
A) savas környezetben benzoesavvá
A benzol homológjain kálium-permanganát és más erős oxidálószerek hatására az oldalláncok oxidálódnak. Bármilyen összetett is a szubsztituens lánca, az elpusztul, kivéve az a -szénatomot, amely karboxilcsoporttá oxidálódik.
A benzol egyoldalláncú homológjai benzoesavat adnak:
A két oldalláncot tartalmazó homológok kétbázisú savakat adnak:
5C 6 H 5 - C 2 H 5 + 12 KMnO 4 + 18 H 2 SO 4 → 5 C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12 MnSO 4 + 28 H 2 O
5C 6 H 5 - CH 3 + 6 KMnO 4 + 9 H 2 SO 4 → 5 C 6 H 5 COOH + 3K 2 SO 4 + 6 MnSO 4 + 14 H 2 O
Egyszerűsített :
C6H5-CH3+3O KMnO4→C 6 H 5 COOH + H 2 O
B) semleges és enyhén lúgos benzoesav sóihoz
C 6 H 5 - CH 3 + 2 KMnO 4 → C 6 H 5 COO K + K OH + 2MnO 2 + H 2 O
II. KIEGÉSZÍTŐ REAKCIÓK (keményebb, mint az alkének)
1. Halogénezés
C 6 H 6 + 3Cl 2 h ν → C 6 H 6 Cl 6 (hexaklór-ciklohexán - hexaklorán)
2. Hidrogénezés
C6H6+3H2 t , PtvagyNi→C 6 H 12 (ciklohexán)
3. Polimerizáció
III. HELYETTESÍTÉSI REAKCIÓK – ionos mechanizmus (könnyebb, mint az alkánok)
1. Halogénezés -
a ) benzol
C 6 H 6 + Cl 2 AlCl 3 → C 6 H 5 -Cl + HCl (klórbenzol)
C 6 H 6 + 6Cl 2 t,AlCl3→C 6 Cl 6 + 6HCl( hexaklór-benzol)
C 6 H 6 + Br 2 t,FeCl3→ C6H5-Br + HBr( bróm-benzol)
b) benzol homológok besugárzás vagy melegítés hatására
Kémiai tulajdonságait tekintve az alkilcsoportok hasonlóak az alkánokhoz. A bennük lévő hidrogénatomokat szabad gyökös mechanizmussal halogénekkel helyettesítik. Ezért katalizátor hiányában a melegítés vagy az UV-sugárzás gyökös szubsztitúciós reakcióhoz vezet az oldalláncban. A benzolgyűrűnek az alkil-szubsztituensekre gyakorolt hatása arra a tényre vezet, hogy a hidrogénatomot mindig a benzolgyűrűhöz közvetlenül kapcsolódó szénatom (a-szénatom) helyettesíti.
1) C6H5-CH3 + Cl2 h ν → C6H5-CH2-Cl + HCl
c) benzol homológok katalizátor jelenlétében
C6H5-CH3 + Cl2 AlCl 3 → (orta keveréke, származékpár) +HCl
2. Nitrálás (salétromsavval)
C 6 H 6 + HO-NO 2 t, H2SO4→C 6 H 5 -NO 2 + H 2 O
nitrobenzol - szag mandula!
C6H5-CH3+3HO-NO2 t, H2SO4→ VAL VEL H3-C6H2(NO2)3+3H2O2,4,6-trinitrotoluol (tol, trotil)
A benzol és homológjainak használata
Benzol A C 6 H 6 jó oldószer. A benzol adalékanyagként javítja az üzemanyag minőségét. Nyersanyagként szolgál számos aromás szerves vegyület előállításához - nitrobenzol C 6 H 5 NO 2 (oldószert, anilint nyernek belőle), klórbenzol C 6 H 5 Cl, fenol C 6 H 5 OH, sztirol stb.
Toluol C 6 H 5 -CH 3 - festékek, gyógyszerek és robbanóanyagok (trotil (tol) vagy 2,4,6-trinitrotoluol TNT) gyártásához használt oldószer.
Xilol C6H4(CH3)2. A technikai xilol három izomer keveréke ( orto-, meta- És pár-xilolok) - oldószerként és kiindulási termékként használják számos szerves vegyület szintéziséhez.
Izopropil-benzol A C 6 H 5 -CH (CH 3) 2 fenol és aceton előállítására szolgál.
A benzol klórszármazékai növényvédelemre használják. Így a benzolban lévő H atomok klóratomokkal történő helyettesítésének terméke a hexaklór-benzol C 6 Cl 6 - gombaölő szer; búza és rozs száraz magcávájára használják kemény sár ellen. A klór benzolhoz való hozzáadásának terméke hexaklór-ciklohexán (hexaklorán) C 6 H 6 Cl 6 - rovarirtó szer; káros rovarok elleni védekezésre használják. Ezek az anyagok peszticidekre utalnak - a mikroorganizmusok, növények és állatok elleni küzdelem kémiai eszközeire.
Sztirol A C 6 H 5 - CH \u003d CH 2 nagyon könnyen polimerizálódik, polisztirol képződik, és butadién-sztirol-butadién gumikkal kopolimerizálódik.
VIDEÓS TAPASZTALATOK





